Plan stratégique 2015-2018
ISBN : 978-0-660-03055-5
No de catalogue : H82-19/2015F-PDF

Version PDF (2.44 MB)
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est une agence de protection des consommateurs ayant un double mandat lié à la réglementation et à l’établissement de rapports. Il veille à ce que les prix des médicaments brevetés vendus au Canada ne sont pas excessifs et fournit aux intervenants des renseignements sur les tendances pharmaceutiques pour les aider à faire des choix éclairés.
1. Message de la Présidente
Au Canada, comme dans de nombreux pays, les coûts des soins de santé augmentent, et les tiers payeurs de partout sont confrontés à la difficulté de concilier des budgets de médicaments limités et l’accès des patients à de nouvelles technologies dans le domaine de la santé, qui sont prometteuses mais dispendieuses. Malgré les récentes tendances de stabilisation dans les dépenses relatives aux médicaments prescrits, la croissance au Canada des ventes de médicaments brevetés continue de dépasser celle observée dans les sept pays auxquels nous nous comparons dans le Règlement sur les médicaments brevetésNote de bas de page 1, à l’exception des États Unis. Parmi ces pays, le Canada se classe maintenant au troisième rang en ce qui a trait aux prix des médicaments brevetés, presque à égalité avec l’Allemagne.
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) a été formé en 1987, dans le cadre de modifications apportées à la Loi sur les brevets, dans le contexte d’une réorganisation majeure du régime de brevets pharmaceutiques au Canada qui visait à maintenir l’équilibre entre des objectifs de politiques susceptibles d’être en concurrence. D’une part, le gouvernement a renforcé la protection que confèrent les brevets aux médicaments afin d’encourager davantage d’investissement en recherche et développement (R-D) de la part de l’industrie pharmaceutique au Canada. D’autre part, le gouvernement a cherché à atténuer les répercussions de ce changement sur les Canadiens en créant le CEPMB, une agence de protection des consommateurs ayant pour mandat de veiller à ce que les prix des médicaments brevetés au Canada ne soient pas « excessifs ».
La législation qui a donné lieu à ces modifications, soit le projet de loi C-22, était alors un sujet très litigieux, et la crédibilité et l’efficacité du CEPMB à titre d’organisme de réglementation étaient considérées comme éléments essentiels pour assurer la viabilité à long terme du compromis stratégique qu’il incarnait.
Dans les années qui ont suivi, la protection de la propriété intellectuelle des produits pharmaceutiques au Canada a été davantage renforcée grâce à une succession de réformes législatives et réglementairesNote de bas de page 2, tandis que le mandat du CEPMB est resté essentiellement le même. Au cours de la même période, de nombreux autres pays développés ayant des systèmes de soins de santé publics ont introduit des mesures pour résoudre les problèmes d’abordabilité, optimiser les ressources et suivre le rythme d’un marché pharmaceutique en évolution rapide.
Dans le contexte de ces dernières évolutions à l'échelle internationale, l'agencement récent des prix relativement élevés des médicaments brevetés et du creux record de la R-D pharmaceutique au Canada soulève des questions légitimes quant à la mesure dans laquelle le CEPMB atteint les objectifs stratégiques initiaux qui étaient sa raison-d’être il y a plus de 25 ans. Par conséquent, le CEPMB a entamé, en 2014, un processus de planification stratégique d’une année afin de proposer une nouvelle marche à suivre pour le prochain quart de siècle qui permettra à l’organisation de s’affirmer à nouveau en tant que garantie efficace contre les prix excessifs des médicaments brevetés et en tant que source encore plus précieuse de renseignements sur le marché pour les décideurs et les payeurs.
Comme il est expliqué ci dessous, les objectifs stratégiques qui ont été cernés pour les années à venir sont fondés sur une évaluation exhaustive menée par le CEPMB en vue de déterminer la façon de réagir aux menaces et aux possibilités actuelles et potentielles dans son environnement opérationnel. Cette réaction repose sur une vision de la manière dont le CEPMB peut optimiser ses forces et compétences législatives uniques pour compléter les efforts de ses partenaires fédéraux, provinciaux et territoriaux et des autres intervenants en vue de la réalisation de notre objectif commun consistant à établir un système de santé durable. La façon dont cette vision commune orientera les travaux quotidiens du CEPMB à l’avenir est exposée en grandes lignes dans son énoncé de mission amélioré, une version plus ambitieuse et inspirante que l’énoncé initial, selon les défis qui se présenteront.
2. Sommaire
Contexte
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) a été formé en 1987, dans le cadre de modifications apportées à la Loi sur les brevets, dans le contexte d’une réorganisation majeure du régime de brevets sur les médicaments du Canada, qui fournissait aux sociétés pharmaceutiques brevetées de plus longues périodes d’exclusivité de marché pour leurs produits. L’objectif initial énoncé du CEPMB était de veiller à ce que les sociétés pharmaceutiques n’abusent pas de leurs droits de brevet nouvellement renforcés en imposant aux consommateurs des prix « excessifs » pour les médicaments brevetés pendant la période de monopole de droits. La protection des consommateurs était un des cinq piliersNote de bas de page 3 ou principes fondateurs sur lesquels s’appuyaient ces modifications législatives.
Avant la mise sur pied du CEPMB, les prix des médicaments brevetés au Canada augmentaient plus rapidement que le taux d’inflation général, et ils étaient bien au-dessus de la médiane des prix à l’étranger; le Canada se classait au deuxième rang, derrière les États Unis, parmi les sept pays de comparaison du CEPMBNote de bas de page 4. Depuis ce temps, les prix sont généralement demeurés inférieurs au taux d’inflation et à la médiane internationale. Cependant, plus récemment, les prix des médicaments brevetés au Canada ont augmenté de façon constante par rapport aux prix observés dans les sept pays de comparaison du CEPMB, et se situent actuellement au troisième rang des prix les plus élevés, presque à égalité avec l’Allemagne.
Tandis que les prix des médicaments au Canada augmentent, les dépenses en R-D par les sociétés pharmaceutiques brevetées diminuent : elles représentaient 5,4 % des ventes en 2013, le résultat enregistré le plus faible depuis que le CEPMB a commencé à établir des rapports sur la R-D en 1988.
Pris ensemble, les prix élevés des médicaments brevetés et le creux record de l’investissement en R-D par les fabricants pharmaceutiques remettent en cause l’efficacité du régime actuel dans l’atteinte de ses objectifs politiques initiaux.
Objectif
L’objectif du présent plan stratégique est de permettre au CEPMB de faire face aux menaces et de saisir les possibilités qui lui sont présentées dans son cadre de fonctionnement de façon à lui permettre de devenir plus fort et plus efficace qu’avant.
Méthode et conclusions
Le processus de planification stratégique d’une année du CEPMB a abouti en une nouvelle vision et un énoncé de mission révisé. Les objectifs stratégiques suivants ont été cernés pour 2015-2018 :
Objectif stratégique 1 – réglementation et rapports axés sur le consommateur
Objectif stratégique 2 – modernisation du cadre
Objectif stratégique 3 – partenariats stratégiques et sensibilisation du public
Objectif stratégique 4 – mobilisation des employés
Objet
Le présent plan stratégique est un document général qui orientera la mise en œuvre des objectifs stratégiques du CEPMB grâce à des plans opérationnels et de ressources humaines détaillés qui seront élaborés et révisés par le personnel chaque année.
3. Rôle du CEPMB
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme quasi judiciaire indépendant, créé par le Parlement en 1987 en vertu de la Loi sur les brevets (Loi). Le CEPMB fait partie du portefeuille de la Santé, mais, en raison de ses responsabilités quasi judiciaires, il exerce son mandat en toute indépendance du ministre de la Santé, responsable des dispositions de la Loi ayant trait au CEPMB.
Il fonctionne également d’une façon indépendante de Santé Canada, qui vérifie l'innocuité et l'efficacité des médicaments; d’autres organismes du portefeuille de la Santé, comme l’Agence de la santé publique du Canada et les Instituts de recherche en santé du Canada; et des régimes d’assurance-médicaments des provinces, qui approuvent l'inscription des médicaments sur leurs formulaires respectifs aux fins de leur admissibilité à un remboursement.
Le CEPMB est une agence de protection des consommateurs ayant un double mandat lié à la réglementation et à l’établissement de rapports. Il veille à ce que les prix des médicaments brevetés vendus au Canada ne sont pas excessifs et fournit aux intervenants des renseignements sur les tendances pharmaceutiques pour les aider à faire des choix éclairés.
Le CEPMB est constitué de son « personnel » et des « membres » du Conseil. Le personnel est composé de fonctionnaires responsables d’effectuer les travaux quotidiens de l’organisation. Les membres sont des personnes nommées par le gouverneur en conseil qui président les audiences visant les allégations de prix excessif. En vertu de la Loi, la présidente du Conseil assume les fonctions de chef de la direction du CEPMB ayant le pouvoir et la responsabilité de superviser et d’orienter ses activités.
a. Mandat en matière de réglementation
Le CEPMB réglemente les prix plafonds « départ-usine » et n’a pas compétence en ce qui concerne les prix de gros ou de détail facturés par les pharmacies. Le personnel passe en revue les prix que les brevetés facturent pour l’ensemble des médicaments brevetés vendus au Canada. S’il détermine que le prix d’un médicament breveté semble excessif et qu’il ne peut s’entendre avec le breveté pour régler le problème, la présidente peut tenir une audience sur la question si elle est d’avis que cela sert l’intérêt public. Les fonctions décisionnelles du CEPMB sont exécutées par les membres. Pendant les audiences, un comité d’étude formé de membres du Conseil agit en tant qu’arbitre neutre entre le personnel du Conseil et le breveté. La présidente décide quels membres feront partie du comité, mais pour des raisons de politique ne participe pas elle-même en tant que membre du comité, en général. Les ministres de la Santé provinciaux et territoriaux peuvent également comparaître devant le comité en tant que parties réglementaires, et d’autres personnes ou groupes intéressés peuvent être autorisés à participer en tant qu’intervenants. Lorsqu’un comité conclut que le prix d’un médicament breveté est en fait excessif, il peut ordonner une diminution du prix à un niveau non excessif. Il peut également ordonner à un breveté de rembourser toute recette excessive et, quand il détermine que le breveté a mis en place une politique de prix excessif, il peut doubler le montant à rembourser.
b. Mandat en matière de rapport
Chaque année, par l’entremise du ministre de la Santé, le CEPMB rend des comptes au Parlement sur ses activités d’examen des prix, les prix des médicaments brevetés, les tendances des prix de l’ensemble des médicaments prescrits et les dépenses en recherche et développement (R-D) déclarées par les sociétés pharmaceutiques brevetées, comme l’exige la Loi. Par ailleurs, en raison de l’établissement en 2001 du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) par les ministres de la Santé fédéral, provinciaux et territoriaux (FPT), le CEPMB effectue des analyses critiques des tendances en matière de prix, d’utilisation et de coût pour les médicaments prescrits, brevetés et non brevetés. Cette fonction a pour objet de fournir aux gouvernements FPT et à d’autres intervenants intéressés une source crédible centralisée d’information sur les tendances pharmaceutiques.
4. Environnement pharmaceutique au Canada
a. Introduction
Il est souvent mentionné que le Canada est le seul pays développé ayant un système de soins de santé financé par l’État qui ne comporte pas d’assurance-médicaments universelle. Des quelque 29 milliards de dollars dépensés en médicaments prescrits en 2013, les tiers payeurs privés étaient responsables de 58 % des paiements (assureurs – 35 % et particuliers – 23 %) et les tiers payeurs publics (principalement les provinces et les territoires), des 42 % restants.
Par conséquent, le Canada est assez unique en ce sens qu’il ne compte pas sur une autorité nationale responsable des achats pouvant utiliser le pouvoir d’achat de l’État pour négocier des prix plus faibles au nom de toute la population. Il existe plutôt une toile complexe d’initiatives, d’ententes et d’organisations fédérales, provinciales, territoriales et du secteur privé qui se chevauchent et qui visent à contenir, voire à contrôler, le coût des médicaments. Le CEPMB est le principal organisme fédéral à cet égard; son pouvoir découle du pouvoir constitutionnel fédéral concernant les brevets d’invention et de découverte. Actuellement, il examine et établit les prix plafonds de l’ensemble des médicaments brevetés vendus au Canada à la lumière du degré d’amélioration thérapeutique, des prix nationaux, des prix dans les sept pays nommés dans le Règlement sur les médicaments brevetés (les sept pays de comparaison du CEPMB)Note de bas de page 5 et de l’évolution de l’indice des prix à la consommation (IPC).
Le CEPMB a été mis sur pied dans le cadre de vastes modifications apportées à la Loi, lesquelles fournissaient aux sociétés pharmaceutiques brevetées de plus longues périodes d’exclusivité de marché. L’objectif énoncé du CEPMB était de veiller à ce que les consommateurs soient protégés de la pratique de prix excessifs pour les médicaments brevetés au cours de la période de monopole nouvellement renforcée.
En 1987, quand le régime de brevets sur les médicaments actuel a été conçu, le gouvernement au pouvoir était déterminé à accroître le niveau d’investissement dans la R-D pharmaceutique au Canada. Les décideurs étaient d’avis que la protection conférée par un brevet et les prix étaient les facteurs clés de cet investissement. On a donc décidé d’offrir un niveau de protection et de prix pour les médicaments comparable à celui d’autres pays ayant une industrie pharmaceutique forte parce qu’on croyait que le Canada aurait des niveaux comparables de R-D. En réaction aux modifications de la Loi, lesquelles ont renforcé la protection que confèrent les brevets aux médicaments, l’organisme Les compagnies de recherche pharmaceutique du Canada (Rx&D)Note de bas de page 6 s’est engagé à doubler son niveau de R-D par rapport au niveau de 1987, qui représentait moins de 5 % des ventes, pour qu’il passe à 8 % en 1991 et à 10 % en 1996Note de bas de page 7.
Effet des politiques sur les prix des médicaments et la R-D
Avant la mise sur pied du CEPMB, les prix des médicaments brevetés au Canada augmentaient plus rapidement que le taux d’inflation général, selon la mesure de l’IPC, et ils excédaient de 23 % la médiane des prix à l’étranger; le Canada se classait au deuxième rang, derrière les États Unis, parmi les sept pays de comparaison du CEPMB. Depuis ce temps, l’augmentation des prix annuelle est demeurée bien en deçà de l’IPC dans presque tous les cas, tandis que les prix globaux ont été équivalents ou inférieurs à la médiane internationale après les importantes révisions apportées aux lignes directrices du CEPMB en 1994Note de bas de page 8. En ce qui a trait à la R-D, les brevetés ont fait d’importants progrès du début au milieu des années 1990, les membres de Rx&D ayant atteint l’objectif de 10 % des ventes trois ans avant la date prévue en 1993, avant d’atteindre leur pic de 12,9 % en 1997.
Cependant, plus récemment, les prix des médicaments brevetés au Canada ont augmenté de façon constante par rapport aux prix observés dans les sept pays de comparaison du CEPMB. En 2005, les prix au Canada étaient les troisièmes plus faibles au sein des sept pays, tandis qu’en 2013, ils étaient les troisièmes plus élevés, presque à égalité avec l’Allemagne, mais bien en deçà de ceux des États Unis. Parmi les cinq pays où les prix étaient les plus bas en 2013, les prix au Royaume-Uni, en France et en Italie étaient de 20 % inférieurs à ceux du Canada. Outre les sept pays de comparaison du CEPMB, les prix en Australie, en Autriche, en Espagne, en Finlande, aux Pays Bas et en Nouvelle Zélande étaient de 17 à 37 % inférieurs à ceux du Canada en 2013. Si l’on tient compte de tous les médicaments prescrits et non seulement des médicaments brevetés, les dépenses par habitant au Canada et en tant que pourcentage du produit intérieur brut (PIB) sont plus élevées que celles de la plupart des autres pays de l’OCDE, à l’exception des États UnisNote de bas de page 9.
Tandis que les prix au Canada augmentent, la R-D diminue. Depuis 2003, les membres de Rx&D n’ont pas respecté leur engagement de 10 %, et le plus récent ratio déclaré publiquement s’établissait à 5,4 % des ventes. Il s’agit du résultat enregistré le plus faible depuis 1988, quand le CPEMB a commencé à faire rapport sur la R-D. Par opposition, le ratio moyen de R-D des sept pays de comparaison du CEPMB est constamment supérieur à 20 %Note de bas de page 10.
Initiatives provinciales et territoriales conjointes récentes concernant l’établissement des prix et l’achat
Dans le cadre de l’accord national sur la santé de 2004, les gouvernements fédéral, provinciaux et territoriaux se sont engagés à suivre un plan décennal pour renforcer les soins de santé. Un aspect clé de ce plan était l’établissement d’une Stratégie nationale relative aux produits pharmaceutiques (SNPP), qui exigeait que les ministres de la Santé examinent les neuf éléments considérés comme essentiels pour assurer un accès équitable aux produits pharmaceutiques pour tous les Canadiens et en fassent rapport. Un programme plus simplifié a réduit cette liste à cinq secteurs prioritaires en 2006, ce qui comprenait l’élaboration d’une liste nationale commune des médicaments et des stratégies d’établissement de prix de gros et d’achat en vrac.
Même si la collaboration fédérale-provinciale-territoriale dans le cadre de la SNPP s’est par la suite étiolée, les provinces et les territoires ont continué d’envisager conjointement des stratégies d’établissement de prix de gros et d’achat en vrac. En 2010, ces travaux ont mené le Conseil de la fédération à établir l’Alliance pharmaceutique pancanadienne (APP). L’APP mène des négociations provinciales/territoriales communes sur les médicaments de marque et les médicaments génériques afin d’accroître la valeur des programmes de médicaments financés par l’État. En date du 31 mai 2015, l’APP avait effectué 71 négociations communes sur des médicaments de marque. En combinaison avec la diminution des prix des médicaments génériques découlant du Processus compétitif d’appel d’offres visant les médicaments génériques, une autre stratégie conjointe d’établissement des prix du Conseil de la fédération, les économies réalisées annuellement sont censément supérieures à 315 millions de dollars. Cependant, les économies attribuables uniquement aux médicaments de marque ne sont pas connues, car les rabais sur les prix courants pour le public négociés par l’APP sont tenus confidentiels à la demande des fabricants pharmaceutiques.
Ces ententes confidentielles, appelées ententes relatives à l’inscription d’un produit (EIP), permettent aux fabricants de faire une discrimination par les prix entre les tiers payeurs et elles sont devenues de plus en plus répandues au cours des dernières années. Les rabais négociés dans le cadre des EIP sont une façon pour les tiers payeurs publics de contenir les coûts, mais les assureurs privés allèguent qu’ils contribuent à l’augmentation des prix dans le marché privé, car les compagnies d’assurance individuelles ont un pouvoir de négociation moindre que la plupart des tiers payeurs publics et ne comptent pas sur un équivalent du secteur privé de l’APPNote de bas de page 11.
Figure 1 : Total au Canada
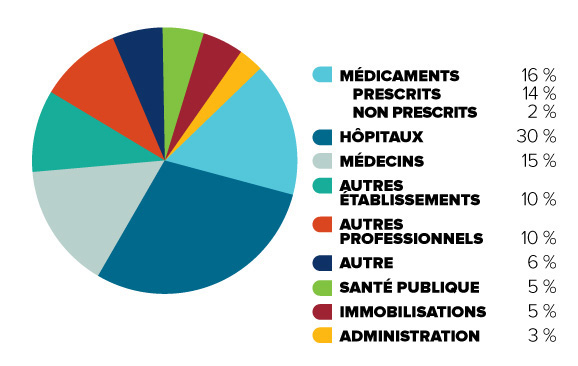
Description de la figure
Le diagramme illustre la décomposition en différentes catégories des dépenses totales en soins de santé au Canada en 2013. Il vise à montrer l’importance relative des divers éléments des dépenses en soins de santé.
En ordre décroissant de la taille, la part des dépenses totales en soins de santé au Canada est affichée comme suit : hôpitaux (30 %), médicaments (16 %, soit 14 % pour les médicaments prescrits et 2 % pour les médicaments non prescrits), médecins (15 %), autres établissements (10 %), autres professionnels (10 %), santé publique (5 %), immobilisations (5 %), administration (3 %), et autre (6 %).
Figure 2 : Particuliers (non assurés)
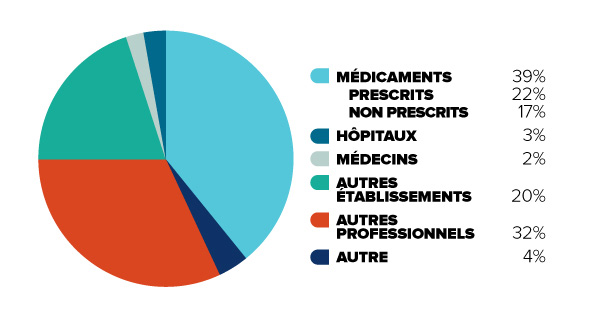
Description de la figure
Le diagramme illustre la décomposition des dépenses totales en soins de santé au Canada en 2012 uniquement pour les coûts assumés par les personnes non assurées (les « particuliers »). Il vise à mettre en contraste ces chiffres par rapport à la figure 1, afin de montrer que pour les Canadiens bénéficiant d’une assurance limitée, certaines catégories de coûts prennent plus d’importance.
En ordre décroissant de la taille, la part des dépenses totales en soins de santé des particuliers au Canada est affichée comme suit : médicaments (39 %, soit 22 % pour les médicaments prescrits et 17 % pour les médicaments non prescrits), autres professionnels (32 %), autres établissements (20 %), hôpitaux (3 %), médecins (2 %), et autre (4 %).
Tendances récentes concernant les dépenses en médicaments
Comme il a été mentionné, les Canadiens ont dépensé près de 29 milliards de dollars en médicaments prescrits en 2013, ce qui constitue une part importante des coûts globaux de soins de santé. Après des taux de croissance à deux chiffres soutenus dans les dépenses en médicaments prescrits il y a une décennie, l’augmentation nette annuelle a ralenti graduellement, atteignant 1,2 % en 2012Note de bas de page 12, faisant des médicaments la catégorie qui a crû le moins parmi les trois principales catégories de dépenses en santéNote de bas de page 13.
La variation de la croissance des dépenses en médicaments prescrits est influencée par un certain nombre d’effets de « poussée » et de « traction ». Par exemple, l’accroissement de la population de bénéficiaires et le recours à des médicaments plus dispendieux entraînent une pression à la hausse sur les dépenses, causant un effet de poussée, tandis que la substitution de médicaments génériques et la diminution des prix entraînent un effet de traction à la baisse. Chaque année, et pour tout segment du marché, l’importance de ces effets varie, et le taux de variation des dépenses en médicaments prescrits évolue donc au fil du temps et varie entre les régimes d’assurance-médicaments publics et privés.
Figure 3 : Indicateurs des coûts des médicaments en 2012-2013
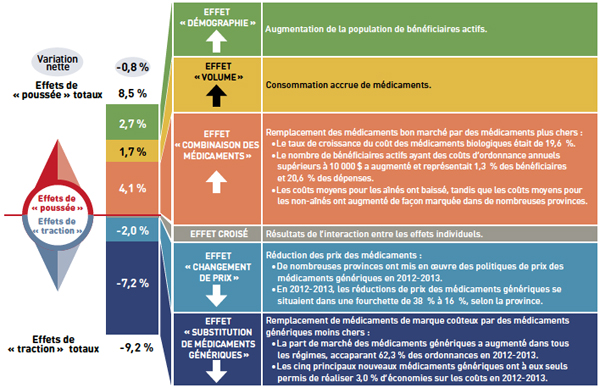
Description de la figure
Le diagramme illustre les inducteurs des coûts des médicaments en 2012-2013, et les divise en effets de poussée (augmentation) ou de traction (réduction). Il fait état des totaux pour les régimes publics d’assurance-médicaments choisis au Canada.
La variation nette globale des coûts des médicaments entre 2011-2012 et 2012-2013 était de -0,8 %.
L’effet de poussée total était de 8,5 % et comprenait les principaux effets suivants :
- L’effet « combinaison de médicaments » (4,1 %) dû au recours accru aux médicaments plus coûteux :
- Le taux de croissance du coût des médicaments biologiques était de 19,6 %.
- Le nombre de bénéficiaires actifs avec des coûts d’ordonnance annuels de 10 000 $ ou plus has est à la hausse, représentant 1,3 % des bénéficiaires et 20,6 % des dépenses.
- Les coûts moyens annuels des aînés ont diminué, alors que les coûts moyens annuels des non-aînés ont augmenté considérablement dans plusieurs provinces.
- L’effet « volume » (1,7 %) dû à l’utilisation accrue de médicaments.
- L’effet « démographie » (2,7 %) dû à l’augmentation de la population de bénéficiaires actifs.
L’effet de traction total était de -9,2 % et comprenait les principaux effets suivants :
- L’effet « substitution de médicaments génériques » (- 7,2 %) dû au passage des produits de marque plus coûteux aux médicaments génériques moins coûteux :
- La part du marché des médicaments génériques a augmenté dans tous les plans, représentant 62,3 % des ordonnances en 2012-2013.
- Les cinq principaux nouveaux médicaments génériques ont à eux seuls généré des économies de 3,0 % en 2012-2013.
- L’effet « variation de prix » (- 2,0 %) dû à une réduction des prix des médicaments :
- Plusieurs provinces ont mis en œuvre des politiques relatives aux prix des médicaments génériques en 2012-2013.
- En 2012-2013, les réductions des prix des médicaments génériques allaient de 38 % à 16 %, selon la province.
Un effet croisé a résulté de l’interaction entre les effets individuels. Aucune valeur n’est accordée à l’effet croisé.
Selon des études récentes du SNIUMP menées par le CEPMB, les taux de croissance relativement faibles observés dans les régimes publics peuvent s’expliquer en grande partie par le phénomène bien connu de « chute des brevets » touchant de multiples « médicaments vedettes » n’étant plus protégés par un brevet pendant une très courte période, ainsi que par les importantes diminutions de prix des médicaments génériques découlant du Processus compétitif d’appel d’offres visant les médicaments génériques. Ces effets de traction sont principalement des événements ponctuels dont l’incidence devrait diminuer au cours des années à venir jusqu’à ce que le phénomène de la chute des brevets se termineNote de bas de page 14. Par opposition, les facteurs de coût des effets de poussée sont des tendances à long terme qui devraient augmenter grandement à mesure que la population vieillit et que de nouveaux médicaments plus dispendieux remplacent la génération précédente de médicaments.
Les rapports les plus récents d’IMS Brogan laissent entendre que le Canada est peut-être déjà rendu à cette nouvelle étapeNote de bas de page 15. En 2014, les ventes totales de médicaments au Canada ont augmenté de 4,4 % et les ventes de médicaments de marque, de 5,6 %. Tous les segments du marché de médicaments de marque ont crû en 2014, et la croissance dans certains segments importants où les prix sont élevés a été marquée, les dépenses en produits biologiques augmentant de 10,4 % et celles en médicaments oncologiques, de 12,3 %. Ce qui est encore plus frappant est le fait que 2014 est une année record au chapitre des lancements de nouveaux produits, les ventes ayant totalisé 289 millions de dollars, près de 10 fois la moyenne historique. Cette augmentation soudaine des dépenses a été causée en grande partie par la mise en marché de médicaments très dispendieux pour le traitement de l’hépatite CNote de bas de page 16.
Répercussions pour le CEPMB
Pris ensemble, les prix relativement élevés des médicaments brevetés et le creux record de la R-D remettent en cause l’efficacité du régime actuel dans l’atteinte de ses objectifs politiques initiaux. Depuis 1987, les données probantes empiriques n’ont pas confirmé la notion selon laquelle les prix et la protection de la propriété intellectuelle sont des facteurs importants de l’investissement de l’industrie pharmaceutique en R-D. Il est de plus en plus reconnu que d’autres facteurs, comme l’endroit où est situé le siège social, l’infrastructure des essais cliniques et les grappes scientifiques, sont plus importants pour déterminer où les investissements ont lieu dans une économie mondialeNote de bas de page 17.
Cette prise de conscience, considérée en fonction des mesures de limitation des coûts prises récemment par les gouvernements provinciaux et territoriaux, lesquelles ont entraîné une diminution du prix des médicaments pour les tiers payeurs publics, soulève des questions légitimes concernant la raison d’être continue d’un organisme fédéral réglementant les prix des produits pharmaceutiques au Canada. Le Conseil et son personnel avaient ces questions à l’esprit quand le CEPMB a entamé son processus de planification stratégique d’un an. Ayant récemment célébré son 25e anniversaire, le CEPMB se trouve à une importante croisée des chemins dans son histoire. Le chemin emprunté à partir de maintenant déterminera s’il continue d’être un organisme fédéral pertinent et efficace de protection des consommateurs en assurant la durabilité du système de santé du Canada, ou s’il sera réduit à un rôle marginal au sein de ce système. Les objectifs stratégiques établis dans le présent document découlent d’une profonde réflexion, d’une autoévaluation et d’un examen complet de l’environnement opérationnel externe et interne du CEPMB. La réalisation attentive de ces priorités au cours des années à venir permettra au CEPMB de s’appuyer sur ses réussites antérieures et de devenir plus fort et plus efficace qu’il ne l’a jamais été, depuis près de trois décennies.
b. Analyse de l’environnement
Le CEPMB œuvre dans un environnement complexe au sein duquel existent des enjeux et des intérêts politiques, économiques, sociaux, juridiques, commerciaux et technologiques interreliés et parfois concurrentiels.
De par sa nature, l’industrie pharmaceutique est une des industries les plus réglementées au monde. Le Canada ne fait pas exception : la réglementation pharmaceutique est un secteur de compétence partagée. À l’échelle fédérale, Santé Canada examine les nouveaux médicaments pour en assurer l’innocuité, l’efficacité et la qualité, et le CEPMB établit leurs prix plafonds tant qu’ils sont brevetés. L’Agence canadienne des médicaments et des technologies de la santé (ACMTS), organisme indépendant sans but lucratif subventionné par les gouvernements fédéral, provinciaux et territoriaux, effectue des évaluations économiques de nouveaux médicaments et formule des recommandations en matière de remboursement aux tiers payeurs publics participants. À l’échelle provinciale et territoriale, les ministres de la Santé et les gestionnaires des régimes d’assurance-médicaments décident quels médicaments sont remboursés à la population de bénéficiaires et négocient les prix directement avec les fabricants pharmaceutiques. À l’extérieur des gouvernements, les compagnies d’assurance-maladie privées gèrent les régimes d’assurance-médicaments des employeurs et négocient également les prix directement avec les fabricants. Les règles établissant si les assureurs privés sont liés par les décisions de remboursement relatives aux régimes d’assurance-médicaments publics ou s’ils bénéficieront des négociations de prix, et dans quelle mesure, varient par province.
Malgré les meilleures intentions, le résultat inévitable du système décrit ci dessus est une approche relativement fragmentée à l’établissement des prix et au remboursement des produits pharmaceutiques, dans le cadre de laquelle des décisions clés sur la réglementation des prix, le rapport coût-efficacité, l’accès du marché et la négociation de prix sont prises de façon cloisonnée. On peut comparer cette approche à celle plus intégrée qui existe dans de nombreux autres pays développés ayant un système de soins de santé public où de telles décisions sont prises par une seule autorité nationale ou des autorités étroitement liées travaillant de concert. Dans les pays où les systèmes comportent de multiples tiers payeurs, les tiers payeurs publics et privés tirent également profit des faibles prix découlant de cette approche.
L’analyse qui suit vise à présenter les facteurs les plus importants façonnant l’environnement opérationnel externe et interne du CEPMB, mais elle n’est en aucun cas exhaustive et les facteurs ne sont pas énumérés par ordre d’importance.
Facteurs externes
1. Réforme internationale des régimes d’établissement des prix et de remboursement
En 1987, quand le modèle de comparaison des prix du CEPMB a été conçu, le concept de la comparaison des prix nationaux et des prix dans d’autres pays était relativement nouveau. De nos jours, la comparaison des prix est beaucoup utilisée pour la réglementation des prix à l’échelle internationale, mais de plus en plus en tant que complément d’autres moyens de limitation des coûts. Uniquement de 2010 à 2012, 23 pays européens ont commencé à planifier ou ont mené d’importantes réformes de leur cadre de réglementation des prix des produits pharmaceutiques pour réaliser davantage d’économies. Plus récemment, des discussions exploratoires ont été tenues entre les ministres de la Santé européens sur la possibilité de « lever le voile » sur les rabais confidentiels dans les pays membres afin d’obtenir un meilleur prix unique partout en EuropeNote de bas de page 18. Dans ce continent, deux des principaux groupes de patients ont appuyé fermement cette idée et ont demandé récemment aux autorités nationales de passer à une négociation commune des prix pour toute l’EuropeNote de bas de page 19.
Au moment où ces réformes ont été mises en œuvre en Europe, les prix des médicaments brevetés au Canada ont augmenté plus rapidement que dans les autres pays européens faisant partie des sept pays de comparaison du CEPMB. Cela est particulièrement apparent dans le cas de l’Allemagne, où une réforme majeure a été menée en 2011. Dans le cadre de la nouvelle loi allemande sur la réforme du marché des produits médicaux (Arzneimittelmarkt-Neuordnungsgesetz – AMNOG), laquelle devrait générer chaque année des économies de l’ordre de 2,2 milliards d’euros, les fabricants doivent montrer qu’un nouveau médicament est supérieur à la norme de soins reconnue au pays afin que le médicament bénéficie d’une prime par rapport aux médicaments existants. S’il est déterminé qu’un médicament offre un avantage supplémentaire, des négociations de prix sont tenues; autrement, il est remboursé au plus faible prix parmi les comparateurs de la même catégorie thérapeutique, y compris les médicaments génériques beaucoup moins chers. Cette approche est différente du régime actuel du CEPMB, qui permet que de nouveaux médicaments brevetés qui affichent une amélioration légère, voire aucune amélioration, par rapport aux médicaments existants (les médicaments appelés « succédanés ») soient vendus à un prix correspondant à la limite supérieure de la catégorie thérapeutique. Cela peut expliquer en partie pourquoi les prix au Canada sont beaucoup plus élevés que les prix médians dans les sept pays de comparaison du CEPMB pour cette catégorie de médicaments, qui comptent pour environ 80 % des nouveaux médicaments examinés par le CEPMBNote de bas de page 20.
Figure 4 : Ratio du prix des médicaments en Allemagne par rapport au Canada, 2005-2013
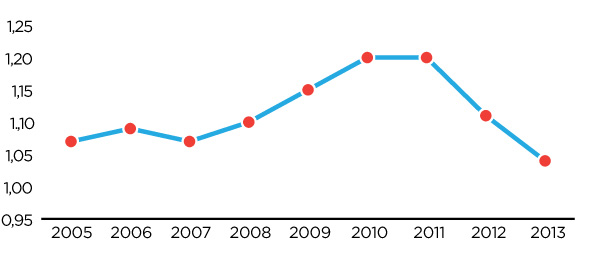
Description de la figure
Le diagramme illustre le ratio des prix des médicaments brevetés en Allemagne par rapport au prix des médicaments brevetés au Canada, au cours de la période de 2005 à 2013. Il vise à montrer, en moyenne, combien de plus un consommateur aurait payé un médicament breveté donné en Allemagne par rapport au prix de ce médicament au Canada au cours d’une année donnée, ainsi que des tendances pertinentes.
Tout au long de la période de 2005 à 2013, les consommateurs en Allemagne ont payé des prix plus élevés que les consommateurs au Canada. Au cours de la période de 2005 à 2007, l’écart des prix était stable, et les consommateurs en Allemagne ont payé environ 7 % de plus que les consommateurs au Canada. Cependant, à compter de 2008, le ratio des prix a augmenté de façon constante, et a atteint son apogée en 2010 alors que les consommateurs en Allemagne payaient environ 20 % de plus le même produit médicamenteux breveté que les consommateurs au Canada. Toutefois, depuis lors, d’importantes réformes réglementaires en Allemagne ont entraîné une chute rapide du ratio; par conséquent, les prix en Allemagne en 2013 n’étaient que 4 % plus élevés que les prix au Canada, en moyenne.
2. Médicaments onéreux
Au cours des dernières années, bon nombre de fabricants pharmaceutiques ont orienté leurs efforts de R-D vers des maladies plus graves touchant une petite population de patients. Les médicaments efficaces qui découlent de ce type de R-D n’ont pas le même volume de vente que la génération de médicaments vedettes qui les a précédés, mais leur prix peut être beaucoup plus élevé. À l’extrémité de cette tendance, on trouve les « médicaments orphelins », qui sont conçus pour traiter des maladies rares et très rares. Parfois, des médicaments initialement conçus pour une petite population de patients peuvent en venir à atteindre un volume de vente et des prix élevés. Une telle situation peut survenir lorsque, par exemple, un nouveau médicament très efficace ayant un usage précis est mis en marché à un prix élevé accepté par les autorités d’établissement des prix et de remboursement et que sa part de marché augmente considérablement au fil du temps, à mesure que des usages supplémentaires sont approuvés ou que des ordonnances à des fins non indiquées sont faites. Dans l’industrie, ces médicaments sont parfois appelés « médicaments de niche ».
Bon nombre de ces médicaments onéreux sont souvent regroupés dans une catégorie intitulée « médicaments spécialisés », qui peut comporter des produits biologiques et des médicaments orphelins et injectables pour certaines maladies, comme le cancer, la polyarthrite rhumatoïde et la SP, pour ne nommer que celles là. Même si la plupart des médicaments orphelins sont des médicaments spécialisés, l’inverse n’est pas vrai. D’ici 2018, on prévoit que les dépenses mondiales en produits pharmaceutiques augmenteront de 30 %, principalement en raison de la croissance des médicaments spécialisés et oncologiques. La croissance exceptionnelle dans ces deux segments de marché devrait représenter 40 % de l’augmentation au cours de cette périodeNote de bas de page 21. À elles seules, les dépenses mondiales en médicaments spécialisés devraient quadrupler d’ici 2020Note de bas de page 22.
Bon nombre de pays éprouvent déjà de la difficulté au chapitre du remboursement public des médicaments onéreux. Les tiers payeurs publics et privés peuvent faire face à une pression énorme quant au remboursement de certains médicaments onéreux, même si ces derniers ne sont pas considérés comme rentables selon les normes établies, en raison de la gravité de la maladie et du manque de traitements de rechange. Au Canada, diverses stratégies ont été utilisées pour aborder cette pression liée aux coûts. À l’échelle provinciale, depuis 2006, les administrations ont tenté d’établir des programmes de remboursement de médicaments onéreux, mais il y avait d’importantes divergences entre les provinces en ce qui a trait aux médicaments assurés, à la période et aux bénéficiaires. En ce qui concerne le marché privé, en 2013, les membres de l’Association canadienne des compagnies d’assurance de personnes (ACCAP) ont convenu du regroupement de médicaments au sein de l’industrie pour atténuer le risque de demandes récurrentes de remboursement de médicaments onéreux prescrits afin de contribuer à diminuer l’effet de ces coûts sur les régimes d’assurance-médicaments des employeurs.
Selon l’ICIS, de 2007 à 2012, deux des trois principales catégories de médicaments ayant contribué le plus à l’augmentation des dépenses publiques en médicaments au Canada étaient les médicaments anti-TNF et les agents contre la néovascularisation, tous deux des produits biologiques onéreux. Les médicaments anti-TNF à eux seuls représentaient 55 % de la croissance des dépenses publiques en médicaments prescrits pendant cette périodeNote de bas de page 23. En 2014, les dépenses en produits biologiques et médicaments oncologiques ont connu une croissance à deux chiffres, et les dépenses pour tous les nouveaux médicaments ont décuplé.
Santé Canada en est aux étapes finales de la mise en œuvre d’un cadre fondé sur le cycle de vie pour les médicaments orphelins en vue de faciliter leur approbation réglementaire et d’attirer plus de médicaments de ce type dans le marché canadien. Cela pourrait augmenter la pression financière pour les tiers payeurs et intensifier le besoin d’adopter des stratégies de limitation des coûts pour assurer l’accès optimal des patients à ces médicaments.
3. Établissement de prix de gros et achat en vrac à l’échelle provinciale
Les régimes d’assurance-médicaments provinciaux et territoriaux assument de plus en plus la responsabilité de trouver des solutions à l’augmentation du coût des médicaments en négociant conjointement des escomptes plus importants que ceux qu’ils pourraient obtenir individuellement. Depuis 2010, deux initiatives de ce type ont été menées par le Groupe de travail sur l’innovation en matière de santé (GTIMS) du Conseil de la fédération :
- L’APP, dirigée par l’Ontario et la Nouvelle Écosse, s’applique à l’ensemble des médicaments de marque pour lesquels on cherche à obtenir du financement par l’entremise de l’Examen pancanadien des médicaments oncologiques (EPMO) ou du Programme commun d’évaluation des médicaments (PCEM) de l’ACMTS;
- La Health Value Initiative, dirigée par la Saskatchewan et la Nouvelle Écosse, a permis d’établir un prix maximum pour 14 molécules génériques à 18 % du prix du médicament de marque équivalentNote de bas de page 24.
Le Conseil de la fédération a annoncé récemment que les deux initiatives sont maintenant regroupées sous l’APP, mais que leurs responsables provinciaux respectifs demeurent les mêmes. En réaction à des recommandations formulées dans un rapport d’IBM commandé par le Conseil de la fédération, des efforts ont été déployés pour officialiser et intégrer les initiatives en 2015, notamment au moyen de l’établissement d’un bureau en Ontario et de l’élaboration de normes concernant sa mission, son mandat, ses principes directeurs et sa gouvernance.
Dans le cadre du processus de demande pour les médicaments de marque de l’APP, une province est responsable de tenir les négociations avec le fabricant du médicament. Si une entente est conclue, la province responsable signe une lettre d’intention avec le fabricant, puis cette dernière est communiquée aux membres de l’APP. Chaque province et territoire se réserve le droit de prendre une décision finale concernant le financement du médicament et de conclure une EIP en fonction des conditions établies dans la lettre d’intention.
En collaborant au sein de l’APP avec des provinces plus grandes, comme l’Ontario, les petites provinces ont vraisemblablement tiré profit de meilleurs prix que ceux qu’elles auraient pu obtenir individuellement, leur permettant de rembourser des médicaments à leur population de bénéficiaires, qui n’auraient pu autrement les acheter. Des opposants font valoir que le fait que les provinces peuvent choisir de ne pas signer une lettre d’intention atténue le pouvoir de négociation prévu par l’initiative, mais les succès remportés jusqu’à maintenant portent certains à croire que le rôle de réglementation du gouvernement fédéral dans l’établissement des prix n’est désormais plus nécessaire.
4. Établissement non transparent des prix
Comme de nombreux pays ont par le passé choisi de réglementer les prix en fonction du prix facturé par les fabricants dans d’autres marchés, une diminution transparente des prix dans un marché peut entraîner une diminution des prix à l’échelle mondiale. Afin de conserver leur capacité de faire une discrimination par les prix dans le marché mondial, les fabricants ont adopté la pratique consistant à négocier des escomptes ou des rabais confidentiels avec les tiers payeurs, ce qui diminue le prix effectif d’un médicament sans changer le prix courant officiel. Cette pratique est devenue si répandue que la Banque mondiale a averti les pays de ne pas recourir uniquement à la méthode consistant à se fonder sur les « meilleurs » prix courants pour contrôler les coûtsNote de bas de page 25.
Au Canada, des EIP conclues entre des tiers payeurs publics et des fabricants, qui établissent des escomptes confidentiels souvent axés sur le volume par rapport au prix courant, sont maintenant la norme de l’industrie. Suivant une décision de la Cour fédérale Note de bas de page 26 rendue en 2009, il n’est pas nécessaire de déclarer ces rabais confidentiels au CEPMB afin qu’il détermine si ses lignes directrices relatives à l’établissement de prix sont respectées, et le CEPMB n’en tient donc pas compte quand il établit les prix plafonds des nouveaux médicaments brevetés en fonction du coût des médicaments de la même catégorie thérapeutique au Canada. Par conséquent, les assureurs privés et les particuliers doivent composer avec des prix courants de nouveaux médicaments brevetés qui ne reflètent pas réellement le coût des médicaments existants dans le marché canadien.
5. Segmentation du marché/discrimination par les prix
Même si les tiers payeurs publics ont récemment obtenu un certain succès en négociant conjointement des diminutions de prix avec les fabricants pharmaceutiques sous l’égide de l’APP, les économies qui en découlent profitent actuellement au marché des provinces et des territoires anglophones, comptant pour moins de 35 %Note de bas de page 27. En outre, les résidents de ces provinces et territoires ayant satisfait aux exigences d’admissibilité de leur régime public respectif ne profitent pas de ces économies en payant de plus faibles montants de participation aux coûts, car ces derniers sont calculés en fonction du prix courant, et non du prix réduit réel, lequel demeure confidentiel. Cela s’applique aux escomptes découlant de l’APP et à ceux découlant d’EIP négociées de façon bilatérale, qui retournent dans les comptes gouvernementaux sous la forme d’une remise de fin d’exercice. Bien que ces remises servent sans aucun doute à atténuer une partie de la pression financière à laquelle sont confrontés les tiers payeurs publics, même l’influence combinée de l’APP ne pourrait pas empêcher une diminution graduelle de la couverture de l’assurance publique prenant la forme d’exigences d’admissibilité plus sévères, de franchises plus élevées et d’une plus grande participation aux coûts, à mesure que la population du Canada vieillit et que l’arrivée massive prévue de médicaments onéreux influe sur le marché. En fait, la génération des baby-boomers qui sont sur le point d’atteindre 65 ans a poussé certaines provinces à passer de régimes d’assurance-médicaments fondés sur l’âge à des régimes fondés sur le revenu en tant que mesure préventive de réduction des coûts.
Les assureurs privés, qui couvrent des dépenses pharmaceutiques au Canada dans une proportion semblable à celle des gouvernements participant actuellement à l’APP, sont également touchés par ces tendances démographiques et en matière de coûts. L’utilisation accrue de médicaments prescrits par les employés et leur famille, l’augmentation du nombre de personnes demandant le remboursement de médicaments onéreux et la part accrue du subventionnement des coûts des médicaments pour les employés à la retraite, occasionnée par les compressions dans l’assurance publique des aînés, entraînent des régimes moins généreux d’assurance-médicaments des employeurs et la diminution du nombre de tels régimes. En plus d’avoir des répercussions évidentes sur la santé et le bien-être des employés actuels et anciens et leur famille, cela signifie qu’il y a également moins de clients pour les gestionnaires de régimes d’assurance-médicaments et l’industrie de l’assurance privée. En 2013, les préoccupations de l’industrie à l’égard de ces tendances ont poussé l’ACCAP à diffuser un document exigeant diverses réformes de la politique sur les médicaments prescrits, lesquelles sont, selon l’Association, nécessaires pour assurer la durabilité de l’assurance-médicaments au Canada. Au nombre des réformes demandées par l’ACCAP, mentionnons la modification du cadre juridique du CEPMB qui établirait des prix plafonds beaucoup plus bas pour les médicaments brevetés afin d’uniformiser les règles du jeu entre les tiers payeurs publics et privésNote de bas de page 28.
Les Canadiens non assurés, notamment les travailleurs à faible revenu dans certaines provinces et les propriétaires de petite entreprise, n’ont pas de pouvoir de négociation et sont souvent ceux qui paient les prix les plus élevés, 1 Canadien sur 10 ayant affirmé être incapable de payer ses médicaments prescrits, selon une étude de 2012 publiée dans le Journal de l’Association médicale canadienne (JAMC).
6. Débat au sujet de l’assurance-médicaments
La sensibilisation accrue aux enjeux découlant de bon nombre des facteurs décrits ci dessus relativement à la durabilité continue du système de santé semble avoir ouvert la porte à une conversation publique sur le bien-fondé d’un régime d’assurance-médicaments national. Au cours de la dernière année, deux études universitaires distinctes ont été menées à cet égard, et les deux ont grandement suscité l’attention des médias.
Gagnon (2014) Note de bas de page 29 affirme que la mise en œuvre de l’assurance-médicaments entraînerait des économies de 3 à 11 milliards de dollars grâce à la diminution des prix, aux gains d’efficacité du système et à l’élimination des frais d’administration des régimes d’assurance-médicaments privés (1,35 milliard de dollars) et des subventions à caractère fiscal (1,20 milliard de dollars). Morgan et ses collaborateurs (2015)Note de bas de page 30 formulent de nombreux arguments semblables et estiment que les économies publiques et privées que permettrait l’assurance-médicaments s’élèveraient à 7,3 milliards de dollars et que le coût des dépenses publiques supplémentaires serait de l’ordre d’environ 1 milliard de dollarsNote de bas de page 31.
L’assurance-médicaments a également fait l’objet d’une discussion pendant une réunion des ministres de la Santé provinciaux et territoriaux et du ministre de la Santé fédéral qui a eu lieu à Banff en octobre 2014. Même si aucun engagement concret n’a été pris, les provinces ont convenu d’approfondir le dialogue intergouvernemental à ce sujet, et le ministre de la Santé de l’Ontario, le Dr Eric Hoskins, s’est proposé en tant qu’émissaire provincial pour présenter le dossier au gouvernement fédéral.
Facteurs internes
7. Ressources humaines
Le personnel du CEPMB est composé d’environ 70 fonctionnaires représentant 11 groupes professionnels différents. Plus de 35 % des employés sont âgés de plus de 50 ans et au moins 10 d’entre eux seront admissibles à la retraite au cours des 5 prochaines années. Depuis 2013, un certain nombre de cadres supérieurs du CEPMB ont quitté l’organisation ou pris leur retraite, notamment deux directeurs, un avocat général et des gestionnaires des groupes d’examen scientifique et d’examen des prix. Dans un rapport de planification de la relève commandé par le CEPMB en 2012-2013, des lacunes ont été relevées concernant le partage des connaissances et la difficulté pour les employés subalternes d’envisager de faire carrière dans l’organisation. Même si des commentaires antérieurs de certains membres du personnel portaient sur l’absence de but au travail et l’incompréhension quant à la manière dont les efforts individuels servent à réaliser ce but, les résultats du plus récent Sondage auprès des fonctionnaires fédéraux montrent une grande amélioration par rapport à 2011 pour un certain nombre d’aspects connexes. Mentionnons notamment le leadership et la confiance à l’égard de la haute direction; la communication de la vision, de la mission et des objectifs de l’organisation; la planification stratégique et l’évaluation des programmes; et les valeurs et l’éthique.
8. Ressources financières
En 2008-2009, le Secrétariat du Conseil du Trésor (SCT) a approuvé une augmentation du financement du CEPMB pour l’aider à réaliser efficacement son mandat. Cela comportait une disposition pour faire passer l’affectation à but spécial (ABS) annuelle à 3,1 millions de dollars pour les dépenses liées aux audiences (cette affectation a été réduite à 2,5 millions de dollars dans le cadre du Plan d’action pour la réduction du déficit).
Pour recevoir davantage de ressources de la part du SCT, le CEPMB a accepté de procéder à l’évaluation de ses programmes en 2011-2012 afin d’établir sa pertinence, son efficience et son efficacité et la mesure dans laquelle les ressources accrues l’aidaient à réaliser ses objectifs. Généralement, les conclusions de l’évaluation étaient positives, et un plan d’action a été mis en œuvre pour répondre aux recommandations du rapport sur les secteurs d’amélioration potentiels. On reconnaît également que la décision du SCT d’augmenter le financement était fondée en partie sur l’hypothèse selon laquelle le nombre d’audiences augmenterait grandement. Jusqu’à maintenant, le CEPMB n’a pas été confronté à l’augmentation anticipée du nombre d’audiences, ce qui lui a conféré une certaine souplesse pour affecter ses ressources en vue d’élargir et d’intensifier ses activités d’établissement de rapports. Cependant, les fonds renouvelables annuels de l’ABS demeurent réservés exclusivement aux dépenses liées aux audiences.
9. Cadre juridique
Le CEPMB œuvre en vertu de l’autorité habilitante de la Loi et du Règlement sur les médicaments brevetés. Le CEPMB a également diffusé le Compendium des politiques, des lignes directrices et des procédures (Compendium) pour veiller à ce que les brevetés soient généralement au courant des politiques, des lignes directrices et des procédures sur lesquelles se fonde le personnel du Conseil pour examiner les prix des médicaments brevetés vendus au Canada.
Contrairement aux autorités d’établissement des prix et de remboursement de nombreux autres pays développés, le CEPMB n’achète pas de médicaments et ne possède donc pas le pouvoir d’achat que ses homologues ont lorsqu’ils tentent d’obtenir auprès de fabricants des concessions en matière de prix. En outre, même s’il réglemente les prix plafonds, le CEPMB n’a pas de pouvoirs illimités, car la Loi permet une intervention quand le prix d’un médicament est considéré comme « excessif » et n’offre que des directives de base relativement à ce que cela signifie de façon pratique.
Figure 5 : Facteurs environnementaux
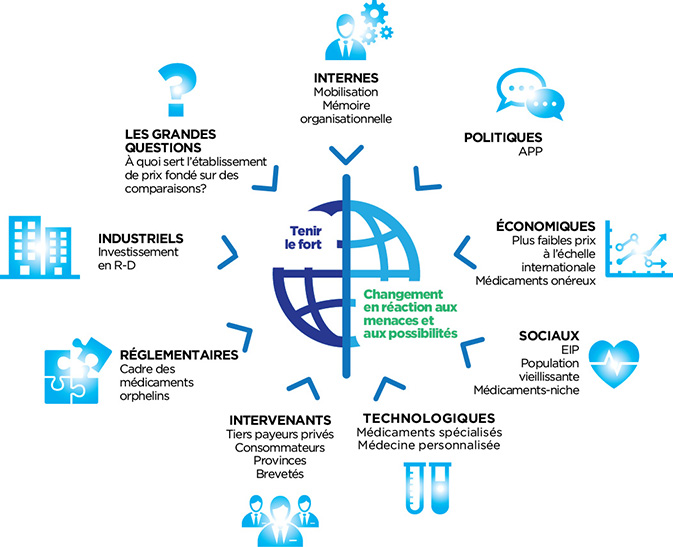
Description de la figure
Le diagramme illustre la relation entre le CEPMB et son environnement complexe interne et externe. Le CEPMB est représenté au milieu du diagramme et est accompagné des descriptions « Tenir le fort » et « Changement en réaction aux menaces et aux possibilités ». Les facteurs environnementaux ayant une incidence sur le CEPMB sont placés autour du périmètre du diagramme de façon à indiquer une relation directe entre chacun des facteurs et le CEPMB. Les facteurs environnementaux sont les suivants :
- Politiques
- Alliance pancanadienne pharmaceutique (APP)
- Économiques
- Plus faibles prix à l’échelle internationale
- Médicaments onéreux
- Sociaux
- Ententes relatives à l’inscription d’un produit (EIP)
- Population vieillissante
- Médicaments-niche
- Technologiques
- Médicaments spécialisés
- Médecine personnalisée
- Intervenants
- Tiers payeurs privés
- Consommateurs
- Provinces
- Brevetés
- Réglementaires
- Cadre des médicaments orphelins
- Industriels
- Les grandes questions
- À quoi sert l’établissement de prix fondé sur des comparaisons?
- Internes
- Mobilisation
- Mémoire organisationnelle
c. Analyse FFPM (forces, faiblesses, possibilités, menaces)
Menaces et possibilités
Les mesures prises par les provinces et les territoires pour mettre en commun leur pouvoir d’achat dans le cadre de l’APP afin de négocier des prix de médicaments moins élevés et d’obtenir plus de valeur pour les régimes d’assurance-médicaments publics soulèvent des questions légitimes concernant la valeur continue des prix plafonds imposés par le CEPMB pour les gouvernements provinciaux et territoriaux. Le fait que le Québec est récemment devenu membre de l’APP ne fait qu’ajouter à ces questionsNote de bas de page 32.
La réussite des réformes apportées récemment à l’établissement des prix et au remboursement dans d’autres pays développés, surtout les pays européens faisant partie des sept pays de comparaison du CEPMB, constitue une autre menace à la capacité du CEPMB d’assurer une uniformité entre les prix des médicaments brevetés au Canada et les normes internationales. Même si les prix au Canada demeurent légèrement en deçà des prix médians dans les sept pays de comparaison du CEPMB, c’est seulement parce que les prix aux États Unis sont beaucoup plus élevés en moyenne que ceux de tous les autres pays de comparaison du CEPMB, ce qui fausse le calcul de la médianeNote de bas de page 33. En outre, si les prix continuent de diminuer en Allemagne en raison de l’AMNOG, le Canada se classera au deuxième rang derrière les États Unis en ce qui concerne les prix, comme c’était le cas avant la création du CEPMB en 1987. À l’heure actuelle, parmi les nombreux pays développés qui recourent à la comparaison des prix à l’échelle internationale, le Canada est le seul pays à effectuer une comparaison avec les prix aux États UnisNote de bas de page 34, ce qui peut avoir un effet aberrant sur les prix au Canada par rapport aux pays européens en raison de la manière dont sont calculés les prix plafonds actuels du CEPMBNote de bas de page 35.
Enfin, il y a un risque que le pouvoir de réglementation des prix du CEPMB s’estompe en raison de décisions judiciaires défavorables sur l’adéquation de ses lignes directrices et l’interprétation appropriée des facteurs prévus par la Loi – ou leur importance – pour déterminer si un prix est excessif.
Même si tous ces facteurs constituent en un sens une menace pour le CEPMB, il s’agit également de possibilités.
En ce qui a trait à l’APP, le CEPMB a pendant longtemps soutenu les efforts déployés en vertu du Processus compétitif d’appel d’offres visant les médicaments génériques en vue d’obtenir une diminution importante du prix des médicaments génériques. Pendant plusieurs années, cette tâche consistait principalement à fournir des données comparatives sur les prix des médicaments génériques au Canada par rapport aux prix à l’échelle internationale. Récemment, le CEPMB a toutefois traité un nombre accru de demandes de provinces responsables dans le cadre des négociations de l’APP pour obtenir de l’information sur les prix de médicaments de marque brevetés à l’échelle internationale. L’adoption récente par l’Alberta de la méthode liée à l’IPC du CEPMB en tant que manière de réglementer l’augmentation des prix des médicaments brevetés et non brevetés dans cette province reflète le partenariat étroit entre le gouvernement fédéral et la province, et il pourrait y avoir d’autres collaborations de ce type. Des possibilités semblables existent dans le marché privé, car il n’y a pas d’organisme gouvernemental indépendant qui examine les questions liées au remboursement et à l’achat propres aux assureurs privés et aux particuliers et qui en fait rapport.
De 1969 à la fin des années 1980, un système spécial d’homologation obligatoire pour les produits pharmaceutiques existait au Canada, ce qui permettait aux fabricants de médicaments génériques de vendre des versions beaucoup moins onéreuses de médicaments de marque brevetés à tout moment pendant la durée du brevet. En raison de ce système, le Canada était critiqué et considéré comme un « profiteur » de la R-D dont les coûts étaient engagés par les autres pays développés où les sociétés pharmaceutiques brevetées disposaient des mêmes droits exclusifs que les brevetés de tout autre domaine technologique. Le facteur précis ayant entraîné les modifications de la Loi qui ont mené à la création du CEPMB et à la réduction, puis à l’élimination, de l’homologation obligatoire a été la négociation d’un accord de libre-échange avec les États Unis, puis de l’Accord de libre-échange nord-américain. Par l’entremise de ces modifications, le Canada a fait savoir qu’il était prêt à payer sa « juste part » des coûts de R-D à l’échelle internationale.
Depuis le début, le CEPMB a considéré que la « juste part » signifiait que les prix au Canada devraient, en moyenne, correspondre aux prix dans les sept pays établis dans l’annexe du Règlement. Avant la publication de ce règlement, les décideurs avaient initialement proposé un échantillon plus représentatif des 23 pays de l’OCDE pour l’annexe; cependant, au moment de la publication de la version finale, ils ont choisi une liste plus représentative en ce sens que les pays sélectionnés avaient des dépenses en R-D correspondant aux niveaux que le Canada avait l’intention d’atteindre. En d’autres mots, les décideurs ont présumé que, en offrant des prix comparables à ceux de ces pays et des droits de brevet complets pour les produits pharmaceutiques, le Canada en viendrait à atteindre leurs niveaux de R-D.
Comme les prix au Canada se classent maintenant au troisième rang parmi les sept pays de comparaison du CEPMB et que la R-D au Canada représente une fraction de la moyenne de ces sept pays (et qu’elle diminue), cette hypothèse n’a clairement pas été confirmée au fil du temps. Compte tenu des discussions tenues au pays au sujet de l’assurance-médicaments, des préoccupations concernent la durabilité d’un régime d’assurance-médicaments suivant l’arrivée prochaine d’une vague de médicaments onéreux et des demandes à l’égard d’une réglementation plus sévère des prix dans le marché privé, le CEPMB a l’occasion de se pencher sur des réformes possibles de son cadre réglementaire. De telles réformes s’appuieraient sur la compréhension actuelle des facteurs stratégiques sous-jacents, comme il est décrit ci dessus, et les priorités actuelles du gouvernement du Canada.
Faiblesses du CEPMB
En tant qu’agence de protection des consommateurs, le CEPMB assume une importante responsabilité sociétale. Les décisions prises par le Conseil dans l’exercice de sa fonction quasi judiciaire peuvent avoir d’importantes conséquences sur le plan de l’économie et de la réputation des sociétés pharmaceutiques brevetées lorsqu’il est déterminé qu’elles ont contrevenu à l’article 83 de la Loi. De plus, en vertu de son mandat, le CEPMB doit rapprocher des objectifs en matière de politiques publiques qui semblent contradictoires, soit l’accès à des médicaments brevetés à des prix abordables pour les tiers payeurs et l’intérêt légitime des fabricants pharmaceutiques d’optimiser la valeur de leur propriété intellectuelle. Il est donc normal de s’attendre à ce que des conflits surviennent régulièrement et à ce que les audiences du Conseil soient courantes. Cependant, ce n’est clairement pas ce que les décideurs envisageaient lorsqu’ils ont créé le régime, compte tenu du fait que le Conseil est composé d’au plus cinq membres à temps partiel nommés par le gouverneur en conseil et qu’il n’a donc pas vraiment la capacité de tenir des audiences. Au bout du compte, le CEPMB doit s’appuyer autant sur la pression morale que sur la menace de l’exécution de la réglementation dans ses relations avec l’industrie, ce qui n’est peut-être pas la façon la plus efficace de promouvoir la conformité avec les règles d’établissement des prix qui, du moins en théorie, peuvent aller à l’encontre des intérêts de l’industrie.
Afin de fonctionner efficacement en tant qu’organisme de réglementation, une autorité gouvernementale doit au moins avoir un aperçu complet et exact des recettes de la partie réglementée générées par la vente de ses produits. Cependant, le CEPMB fait face à deux obstacles à cet égard, car les sources des prix à l’étranger accessibles au public sur lesquelles il s’appuie et les renseignements qui lui sont déclarés par les brevetés ne tiennent pas compte des escomptes et des rabais confidentiels qui sont maintenant la norme à l’échelle nationale et internationale dans les ententes négociées entre les fabricants pharmaceutiques et les assureurs. On peut dire qu’un des avantages de cette approche est une comparaison uniforme des prix nationaux et internationauxNote de bas de page 36, mais cela n’est que peu de réconfort pour les assureurs privés et les particuliers au Canada, qui paient beaucoup plus que les tiers payeurs publics du pays, en partie en raison de prix plafonds qui sont artificiellement gonflés. Si le CEPMB a pour objectif d’être un organisme de réglementation des prix efficace, il doit s’adapter aux réalités du marché, comme les EIP.
Forces du CEPMB
En tant que petit organisme, le CEPMB compte sur un effectif restreint mais souple possédant un vaste éventail de compétences et d’antécédents professionnels. Par conséquent, il est bien outillé pour s’adapter aux changements de son environnement en rajustant ses priorités chaque année d’une façon qui lui permet de mieux réaliser ses mandats en matière de réglementation et de rapport.
Au fil des ans, le CEPMB s’est appuyé sur sa fonction d’établissement de rapports pour renforcer sa réputation de courtier honnête et de source impartiale de renseignements à jour sur le marché pour ses intervenants. Le CEPMB possède l’expertise, les ressources financières et la capacité interne pour faire fond sur cette réputation en accroissant la portée des questions sur lesquelles il fait rapport pour joindre un plus vaste public, surtout les universitaires, les tiers payeurs privés et les consommateurs, et hausser le profil de ces travaux grâce à une politique de communication plus proactive.
En ce qui concerne son mandat en manière de réglementation, le CEPMB pourrait utiliser son ABS de matière plus ciblée pour s’attacher à des dossiers qui lui permettraient d’aborder des aspects de son cadre juridique qui le rendraient plus efficace pour réaliser son mandat et qui comptent le plus pour les tiers payeurs.
5. Planification stratégique
a. Processus
La planification stratégique est le processus par lequel une organisation établit son objet, ses valeurs et son orientation future, pour ensuite prendre des décisions sur les affectations de ressources à effectuer pour suivre cette orientation afin de réaliser son objet et de respecter ses valeurs. Le plan stratégique du CEPMB établit les objectifs pluriannuels nécessaires pour réaliser sa mission et sa vision afin d’exécuter son mandat. Des priorités annuelles harmonisées avec ces objectifs sont énoncées dans le Rapport sur les plans et les priorités (RPP) et le Rapport ministériel sur le rendement (RMR) du CEPMB, tout comme des mesures de rendement précises pour évaluer la mesure dans laquelle des progrès sont réalisés chaque année par rapport à chacune des priorités.
Le processus de planification stratégique actuel a commencé en décembre 2013 dans le cadre d’une réunion entre le directeur exécutif nouvellement nommé et les employés pour discuter des résultats du Sondage auprès des fonctionnaires fédéraux 2011. Pendant cette réunion, le directeur exécutif s’est engagé à aborder les préoccupations soulevées par les employés concernant le manque de confiance à l’égard de la direction et les consultations et communications inadéquates avec les employés en ce qui a trait au mandat et aux priorités du CEPMB.
En avril 2014, le directeur exécutif et les autres membres de l’équipe de direction ont présenté au Conseil une analyse détaillée de l’environnement opérationnel du CEPMB. En juin 2014, le CEPMB a fait appel à un consultant externe pour l’aider à mener son processus de planification stratégique. En octobre 2014, le CEPMB a tenu une assemblée générale pour mobiliser tous les employés au sujet des questions nationales et internationales ayant une incidence sur le travail de l’organisation et obtenir leurs commentaires sur une vision proposée, un énoncé de mission révisé et de nouveaux objectifs stratégiques potentiels. Dans les mois qui ont suivi, la direction et les employés se sont réunis pour discuter des initiatives et des projets précis qui pourraient servir de point de départ à la réalisation des objectifs stratégiques. Ces discussions ont par la suite mené à la création de plans opérationnels complets pour chacune des directions en 2015-2016, dont l’essence découle du présent document, lequel est un plan de base pour toute l’organisation pour les trois prochaines années. Le présent document a été approuvé par la présidente suite à la réunion du Conseil tenue le 15 mai 2015.
b. Thèmes, vision et énoncé de mission révisé
Thèmes
Le point de départ naturel de la mise en œuvre des nouveaux objectifs stratégiques est la formulation d’une nouvelle vision et d’un nouvel énoncé de mission. La vision du CEPMB décrit l’état final idéal que l’organisation aimerait atteindre grâce à l’exécution du plan stratégique. L’énoncé de mission décrit les aspirations de l’organisation et ce qu’elle fait pour réaliser la vision. Une vision et un énoncé de mission bien formulés devraient inspirer le personnel et lui rappeler constamment « pourquoi » il fait son travail, en « quoi » ce dernier consiste et « comment » l’exécuter.
L’énoncé de mission actuel du CEPMB remonte à 1993 et il réitère principalement ses mandats en matière de réglementation et de rapport. Le CEPMB a déjà produit des documents tournés vers l’avenir, mais il n’a pas jusqu’à maintenant établi une réelle vision pour l’organisation.
Les trois thèmes distincts suivants ont orienté la réflexion du CEPMB dans le cadre de l’élaboration des nouveaux objectifs stratégiques : 1) pertinence; 2) relations et 3) renouvellement. Ces thèmes doivent être des pierres de touche pour l’organisation tandis qu’elle procède à la mise en œuvre du plan stratégique. La « pertinence » concerne le désir de l’organisation de faire face aux menaces dans son environnement et de contribuer de façon importante à la durabilité des dépenses pharmaceutiques au Canada, en protégeant et en habilitant les tiers payeurs et les consommateurs. Le thème des « relations » reconnaît que le CEPMB doit assumer un rôle unique dans un environnement de réglementation complexe qui évolue rapidement, obtenir des appuis pour sa vision et sa mission en nouant des partenariats stratégiques avec des tiers payeurs publics et privés et des consommateurs et accroître la sensibilisation à l’égard de son rôle auprès du public en général. Le « renouvellement » reflète la compréhension fondamentale selon laquelle la capacité du CEPMB de réaliser le plan stratégique est fonction de sa capacité de recruter, de former et de conserver des employés compétents et engagés qui soutiennent la vision et l’énoncé de mission.
Vision
Un système pharmaceutique durable dans le cadre duquel les tiers payeurs obtiennent l’information dont ils ont besoin pour faire de bons choix en matière de remboursement et les Canadiens ont accès à des médicaments brevetés à des prix abordables.
Énoncé de mission
Nous sommes un organisme public respecté qui contribue de façon unique et précieuse à la durabilité des dépenses en produits pharmaceutiques au Canada au moyen des mesures suivantes :
- Fournir aux intervenants des renseignements sur les prix, les coûts et l’utilisation pour les aider à prendre en temps opportun des décisions éclairées en matière de prix des médicaments, d’achat et de remboursement.
- Exercer un contrôle efficace sur les droits de brevet des fabricants pharmaceutiques grâce à l’exercice responsable et efficient de ses pouvoirs en matière de protection des consommateurs.
Devise
Protéger, habiliter, s’adapter
6. Objectifs stratégiques de 2015 à 2018
Objectif stratégique 1 : Réglementation et rapports axés sur le consommateur
Quand la politique actuelle en matière de brevets de médicaments a été adoptée en 1987, le CEPMB était décrit comme le « pilier de la protection des consommateurs » de la loi portant modification, soit le projet de loi C 22. Cette description a été appuyée à de multiples occasions par les tribunaux, y compris la Cour suprême du Canada en 2011, lorsqu’elle a conclu que, dans l’interprétation de son propre cadre de réglementation, le CEPMB doit accorder une importance prépondérante à son mandat de protection des consommateurs et à sa responsabilité qui consiste à veiller à ce que les brevetés n’abusent pas de leur monopole « au détriment des patients canadiens et de leurs assureursNote de bas de page 37 ». Pour tirer cette conclusion, la Cour s’est appuyée en grande partie sur des déclarations semblables à la suivante, faite par le ministre parrain du projet de loi C 22, l’honorable Harvie Andre, à la deuxième lecture du projet de loi à la Chambre des communes :
« À mon humble avis, si l’on examine objectivement notre proposition, on verra que nous avons mis sur pied un énorme mécanisme de poids et contrepoids pour nous assurer que le prix à la consommation des médicaments demeurera raisonnable. On verra que la mesure proposée aura des résultats en matière de recherche et de développement et aussi de création d’emplois. »
Une autre déclaration semblable a été faite en 1992 par l’honorable Pierre Blais, ministre parrain du projet de loi qui a suivi, le projet de loi C 91 :
« […] Ce projet de loi … garantit également que la population canadienne pourra continuer d’acheter des médicaments brevetés à des prix qui sont raisonnables et qui le demeureront. »
À une époque où les prix des médicaments brevetés au Canada augmentent plus rapidement que ceux des sept pays de comparaison du CEPMB (à l’exception des États Unis) et d’autres pays européens, où la R-D a atteint un creux record et où les tiers payeurs sont aux prises avec l’arrivée massive sur le marché de médicaments onéreux, le CEPMB, s’il veut continuer à respecter l’intention initiale de la politique, doit adopter une approche davantage axée sur le consommateur relativement à la façon dont il assume ses fonctions en matière de réglementation et de rapport. Note de bas de page 38
En ce qui concerne la fonction de réglementation, le personnel du Conseil, même s’il continuera de favoriser la conformité volontaire par l’entremise de l’application pragmatique de ses lignes directrices, concentrera ses ressources relatives à l’application de la loi sur les cas les plus pertinents pour les payeurs, et sur ceux qui soulèvent des questions qui pourraient clarifier certains aspects du cadre de réglementation du CEPMB, lui permettant de devenir un champion plus efficace des consommateurs. Il envisagera également des solutions pour que son processus d’établissement des prix plafonds soit plus précis et conforme à la politique afin que tous les consommateurs aient droit à des prix abordables.
Pour ce qui est de sa fonction d’établissement de rapports, le CEPMB collaborera avec les tiers payeurs publics et privés pour tirer profit d’autres occasions de collaboration, notamment en mettant en place des systèmes qui faciliteront et normaliseront la diffusion de données sur les prix, l’utilisation et les coûts afin que les assureurs puissent prendre plus rapidement des décisions éclairées, au bénéfice des patients.
Objectif stratégique 2 : Modernisation du cadre
Le régime canadien est demeuré essentiellement le même depuis 1987, tandis que des régimes équivalents dans de nombreux autres pays développés ont été grandement réformés pour résoudre les problèmes d’abordabilité, optimiser les ressources et suivre le rythme d’un marché pharmaceutique en évolution rapide. À la lumière de ce qui précède, le CEPMB déterminera s’il est justifié d’apporter des changements à son cadre réglementaire et établira l’ampleur de ces changements s’il veut veiller à ce que les Canadiens paient leur juste part des prix des médicaments brevetés, comme cela était initialement prévu. À court terme, cela suppose l’examen de différentes solutions pour moderniser et simplifier les lignes directrices du Conseil, conformément au modèle de changement progressif qui est utilisé depuis 1987. L’examen reposera sur diverses questions découlant de l’analyse de l’environnement, notamment les suivantes :
- Abordabilité
- Pouvoir de marché
- Transparence des prix
- Écart entre les prix au Canada et ceux des sept pays européens de comparaison du CEPMB
- Différence de prix entre les tiers payeurs publics et privés
- Fardeau réglementaire
À long terme, le CEPMB mobilisera ses partenaires fédéraux, provinciaux et territoriaux dans le cadre de discussions sur des réformes plus vastes qui tiendraient compte des pratiques exemplaires à l’échelle internationale, notamment la prise de décisions plus intégrées en ce qui a trait au rapport coût-efficacité, au remboursement et l’établissement des prix.
Objectif stratégique 3 : Partenariats stratégiques et sensibilisation du public
Si le CEPMB souhaite réussir à simplifier et à moderniser ses lignes directrices et à réformer globalement la réglementation et la législation fédérales, il doit nouer des relations avec un réseau hétérogène d’intervenants de l’industrie pharmaceutique ayant tous des intérêts et des points de vue quant à ces changements. Afin que ce processus soit efficace, le CEPMB doit accroître la sensibilisation à son mandat de protection des consommateurs et s’appuyer sur sa réputation de courtier honnête auprès des intervenants et du public en général. Pour ce faire, il s’appuiera sur une approche à quatre volets.
Tout d’abord, il renforcera son partenariat avec les tiers payeurs publics pour fournir en temps opportun encore plus de renseignements pertinents sur le marché. Ensuite, il accroîtra la portée des sujets de nature pharmaceutique sur lesquels il fait rapport pour fournir aux tiers payeurs privés et aux consommateurs des renseignements afin de les aider à faire de meilleurs choix plus rentables. En outre, il collaborera étroitement avec ses homologues internationaux afin d’assurer le partage des connaissances et des pratiques exemplaires. Enfin, il adoptera une approche plus proactive concernant la communication de ses réalisations en matière de réglementation et de rapport aux intervenants et au public.
Objectif stratégique 4 : Mobilisation des employés
L’effectif du CEPMB est son plus grand atout. Pour maintenir des normes d’excellence et convaincre les employés que le CEPMB est une organisation où on souhaite faire carrière, le Conseil doit attirer, recruter et conserver des employés très spécialisés, compétents, motivés et diversifiés et rajeunir son effectif. Pour ce faire, le CEPMB continuera d’informer et de mobiliser ses employés dans le cadre de la mise en œuvre du processus de planification stratégique et à mesure que des priorités annuelles sont élaborées et précisées et il leur fournira des directives claires sur les objectifs de travail et les comportements attendus afin de promouvoir une culture où le rendement est continuellement élevé. Il mettra également en œuvre une stratégie de communication interne complète pour permettre des dialogues plus structurés entre les directions, les gestionnaires et les employés et fournir régulièrement à ces derniers des occasions d’entendre un vaste éventail d’experts sur les questions globales qui ont une incidence sur notre environnement opérationnel. Les employés pourront indiquer la mesure dans laquelle leurs gestionnaires réalisent leurs objectifs de mobilisation, et ces commentaires orienteront les cotes de rendement que les cadres supérieurs reçoivent à la fin de l’exercice.
Le CEPMB fournira l’accès à un vaste éventail d’occasions d’apprentissage et de perfectionnement et encouragera les employés subalternes à observer leurs collègues plus expérimentés et à prendre connaissance des problèmes, des enjeux et des situations qui les attendent à mesure qu’ils graviront les échelons de l’organisation. Il cherchera à fournir à ses employés des occasions de détachement et d’échange avec d’autres organisations du gouvernement fédéral afin qu’ils puissent améliorer leur connaissance et leur compréhension de l’appareil gouvernemental. Il continuera d’élargir ses ensembles de compétences diversifiés en embauchant de nouveaux employés du gouvernement et de l’extérieur ayant l’expérience et les capacités pour lui permettre de réaliser ses autres objectifs stratégiques.
7. Conclusion
Le présent plan stratégique est un document général qui orientera la mise en œuvre des objectifs stratégiques du CEPMB grâce à des plans opérationnels et de ressources humaines détaillés. La prochaine étape pour le CEPMB consistera à déterminer les cibles et les réalisations attendues pour établir un lien entre les priorités énoncées dans les plans opérationnels des directions et les mesures concrètes qui seront prises pour les réaliser chaque année au cours des trois années à venir. Le cycle de planification du CEPMB établira un lien plus étroit entre la planification des ressources humaines, des activités et des finances et la planification stratégique. Le présent plan stratégique établit une vision triennale, mais le CEPMB réévaluera ses priorités chaque année et les rajustera, au besoin, pour veiller à ce qu’il continue d’anticiper les nouvelles menaces et possibilités dans son environnement et d’y réagir. Ayant établi notre nouvelle marche à suivre, nous nous engageons maintenant à la suivre vers un avenir meilleur.