Aperçu statistique de 2015
Mandat de réglementation
- 1 359 produits médicamenteux brevetés pour usage humain ont fait l’objet d’un rapport au CEPMB, dont 86 nouveaux produits médicamenteux brevetés.
- En date du 31 décembre 2015, 5 engagements de conformité volontaire ont été acceptés.
- Des recettes excessives totalisant 7,1 millions de dollars ont été remboursées au moyen de paiements au gouvernement du Canada, en plus de réductions de prix.
- 2 avis d’audiences distincts ont été émis au sujet des allégations selon lesquelles Galderma Canada Inc. (Galderma) et Baxalta Canada Corporation (Baxalta) n’auraient pas fourni au CEPMB les renseignements exigés relativement à l’établissement des prix et à la valeur des ventes.
Mandat de rapport
Tendances observées au niveau des ventes :
- Les ventes de produits médicamenteux brevetés au Canada ont atteint 15,2 milliards de dollars en 2015, soit une augmentation de 9,5 % par rapport à 2014.
- Les produits médicamenteux brevetés ont accaparé 61,8 % du total des ventes de médicaments au Canada, soit une augmentation par rapport à 59,9 % en 2014.
Tendances observées au niveau des prix :
- Les prix des produits médicamenteux brevetés existants sont demeurés stables, alors que l’Indice des prix à la consommation a augmenté de 1,1 %.
- Les prix au Canada se situaient au troisième rang des prix les plus élevés par rapport aux sept pays de comparaison du CEPMB, étant inférieurs aux prix en Allemagne et aux États-Unis.
Recherche et développement (R-D) :
- Les brevetés ont fait rapport de dépenses de R-D totalisant 869,1 millions de dollars, soit une diminution de 9,7 % par rapport à 2014.
- Les brevetés membres de Médicaments novateurs Canada (anciennement Rx&D) ont fait rapport de dépenses de R-D totalisant 767,4 millions de dollars, soit une augmentation de 7,8 % par rapport à 2014.
Les ratios des dépenses de R-D par rapport aux recettes tirées des ventes ont enregistré un recul en 2015 :
- 4,4 % chez tous les brevetées, une augmentation par rapport à 4,3 % en 2014
- 4,9 % chez les brevetés membres de Médicaments novateurs Canada, une augmentation par rapport à 4,8 % en 2014.
Lettre à la Ministre
Le 29 juillet 2016
L’honorable Jane Philpott, députée
Ministre de la Santé
Chambre des communes
Ottawa (Ontario)
K1A 0A6
Madame la ministre,
J’ai le plaisir de vous présenter, conformément aux articles 89 et 100 de la Loi sur les brevets, le Rapport annuel du Conseil d’examen du prix des médicaments brevetés pour l’exercice terminé le 31 décembre 2015.
Croyant le tout conforme, je vous prie d’agréer, Madame la ministre, l’assurance de mes sentiments distingués.
Mary Catherine Lindberg
Présidente
Message de la Présidente
Je suis heureuse de présenter le Rapport annuel 2015 du Conseil d’examen du prix des médicaments brevetés (CEPMB). Le CEPMB est un organisme de protection des consommateurs qui exécute un double mandat de réglementation et de production de rapports. Dans le cadre de son mandat de réglementation, il s’assure que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs. Son mandat de production de rapports consiste à informer les intervenants des dernières tendances relatives aux ventes et aux prix des produits pharmaceutiques ainsi que des dépenses de recherche-développement (R-D) dans ce domaine au Canada.
La dernière année a été une année particulièrement chargée pour le CEPMB. En ce qui concerne son mandat de réglementation, le CEPMB a établi des engagements de conformité volontaire à la suite d’enquêtes sur le prix de cinq médicaments brevetés en vertu desquels les titulaires de brevets pharmaceutiques ont versé 7,1 millions de dollars en recettes excédentaires au gouvernement du Canada en 2015, ce montant ayant augmenté à 8,1 millions de dollars en date du 31 mai 2016. Le CEPMB a aussi entamé deux audiences pour défaut de produire visant Baxalta Canada Corporation et Galderma Canada Inc. Pour ce qui est des autres développements juridiques liés à notre mandat de réglementation, en novembre 2015, la Cour d’appel fédérale a rendu une décision créant un précédent en confirmant qu’une personne n’a pas besoin de posséder le brevet d’un médicament donné pour être considérée comme « brevetée » (titulaire du brevet) pour ce médicament au sens du paragraphe 79(1) de la Loi sur les brevets (Loi). En confirmant la conclusion rattachée à la décision initiale du Conseil, la Cour d’appel fédérale a déterminé que les passages de la Loi qui concerne le CEPMB doivent être formulés de manière à mettre l’accent sur les personnes ayant besoin de protection contre les prix excessifs (les consommateurs) plutôt que celles ayant le pouvoir d’engendrer ces prix excessifs (titulaire du brevet). La décision a aussi confirmé la constitutionnalité des articles 79 à 103 de la Loi. À cet égard, la Cour d’appel fédérale a jugé que le Conseil avait, à juste titre, établi que la réglementation des prix exigés pour les médicaments brevetés est une compétence conférée au Parlement en vertu du paragraphe 91(22) de la Loi constitutionnelle de 1867 lorsqu’il s’agit de titulaires, de détenteurs ou de propriétaires de brevet ou de toute autre personne exerçant des droits en vertu d’un brevet (comme un titulaire de licence).
En ce qui a trait à son mandat de production de rapports, le 31 mars 2015, le CEPMB a publié la première édition de son rapport annuel en vertu de l’initiative du Système national d’information sur l’utilisation des médicaments prescrits, CompasRx. Ce rapport phare demeure le seul de son genre qui cerne les principaux moteurs à l’origine des changements observés en matière de dépenses en médicaments d’ordonnance au sein des régimes publics d’assurance-médicaments au Canada. En décembre 2015, le CEPMB a publié deux autres études du SNIUMP, soit Les régimes privés d’assurance-médicaments au Canada – Partie I : Marché des médicaments génériques 2005-2013 et la 7e livraison de L’Observateur des médicaments émergents, et en février 2016, il a publié le rapport Génériques360 – Médicaments génériques au Canada, 2014. Par l’entremise de ses rapports impartiaux, le CEPMB contribue à la discussion générale au sein de la société sur la façon de concilier des budgets de médicaments limités et l’accès des patients à de nouvelles technologies de la santé prometteuses et prépare les Canadiens, que ce soit les gestionnaires de régimes d’assurance-médicaments ou les consommateurs, en vue des décisions importantes qui devront être prises dans l’avenir.
Enfin, mais certainement pas des moindres, le CEPMB a publié en décembre 2015 son Plan stratégique 2015-2018. Les objectifs stratégiques qui y figurent découlent d’une évaluation rigoureuse menée par le CEPMB en vue de déterminer la façon de réagir aux menaces et aux possibilités actuelles et potentielles dans son environnement opérationnel. Cette réaction repose sur une vision commune de la façon d’optimiser nos forces et nos compétences législatives uniques pour compléter les efforts de nos partenaires fédéraux, provinciaux et territoriaux et des autres intervenants en vue d’atteindre notre objectif commun, soit un système de santé durable.
Puisque je terminerai mon deuxième mandat en juin 2016, il s’agit de mon dernier Rapport annuel. Ce fut un grand privilège d’assumer la présidence du CEPMB au cours des cinq dernières années et je tiens à remercier mes collègues du Conseil pour leur expertise, leur dévouement et leur travail acharné. Je désire également remercier le personnel pour son engagement, son enthousiasme et son appui continu. Je vous souhaite tous beaucoup de succès dans la réalisation de l’important mandat de protection des consommateurs du CEPMB. La publication de notre document de consultation sur la réforme des Lignes directrices en juin 2016 sera le dernier jalon de mon parcours à la présidence. Beaucoup de choses ont changé dans l’environnement opérationnel du CEPMB au cours de la dernière décennie et j’ai confiance que la rétroaction qui sera fournie par un large éventail d’intervenants pendant la période de consultation publique, soit après la publication du document, nous permettra d’harmoniser l’ensemble des lignes directrices à ces changements et de faire un grand pas vers l’objectif du gouvernement de rendre les médicaments d’ordonnance plus abordables et accessibles pour tous les Canadiens.
Mary Catherine Lindberg
Le Conseil d’examen du prix des médicaments brevetés : Agir dans l’intérêt des canadiens
Le CEPMB a été établi en 1987 en tant que « pilier » de la protection du consommateur du projet de loi C-22, mesure législative qui visait également à renforcer les droits de brevet des fabricants de produits pharmaceutiques afin de stimuler l’investissement dans la recherche de développement (R-D) au Canada.
Le CEPMB est chargé de protéger les consommateurs en réglementant le prix des médicaments brevetés au niveau départ usine, et de suivre attentivement les tendances dans l'établissement des prix et la R-D au sein de l’industrie. Dans le cadre de sa fonction de rapport, il agit en tant que source d’information objective et centralisée sur les tendances pharmaceutiques pour les décideurs, les sociétés pharmaceutiques, les assureurs privés et d’autres intervenants.
Nous sommes un organisme indépendant
chargé d’administrer les dispositions de la Loi sur les brevets du Canada relatives aux médicaments brevetés. En tant que membre du portefeuille de la Santé, il contribue à un système de soins de santé durable pour l’ensemble de la population canadienne.
1 359 produits médicamenteux brevetés
1 359 produits médicamenteux brevetés ont fait l’objet d’un rapport au CEPMB en 2015.
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987 en vertu de la Loi sur les brevets (la Loi).
Le CEPMB est un organisme de protection des consommateurs qui exécute un double mandat de réglementation et de production de rapports. Dans le cadre de son mandat de réglementation, il s’assure que les produits médicamenteux brevetés ne sont pas vendus au Canada à des prix excessifs. Le Conseil fait également le point sur les tendances observées au niveau des ventes de produits pharmaceutiques et de l’établissement des prix pour tous les médicaments, ainsi que les dépenses de recherche-développement (R-D) des brevetés. Son mandat de rapport fournit aux payeurs de produits pharmaceutiques et aux décideurs les renseignements nécessaires pour prendre des décisions rationnelles et fondées sur des données probantes en ce qui a trait au remboursement et à l’établissement des prix.
La protection des consommateurs dans un marché complexe
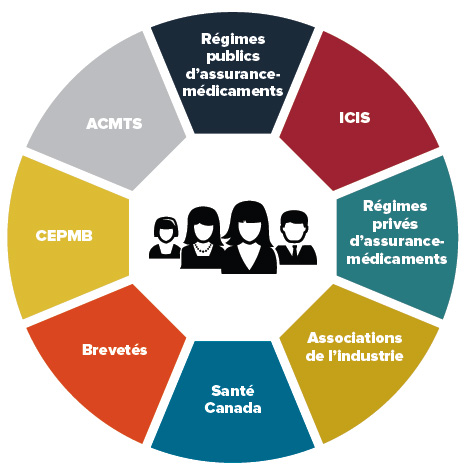
Description de la figure
Les consommateurs canadiens sont représentés de façon symbolique par des images génériques d’un homme et d’une femme au centre d’un cercle divisé en segments. Chaque segment du cercle représente une organisation ou une catégorie d’organisations faisant partie de l’environnement pharmaceutique canadien : Régimes publics d’assurance-médicaments; ICIS; Régimes privés d’assurance-médicaments; Associations de l’industrie; Santé Canada; Brevetés; CEPMB; ACMTS.
Le CEPMB fait partie du portefeuille de la Santé, qui est également constitué de Santé Canada, de l’Agence de la santé publique du Canada, des Instituts de recherche en santé du Canada et de l’Agence canadienne d’inspection des aliments. Le portefeuille de la Santé aide le ministre de la Santé à maintenir et à améliorer la santé des Canadiens.
Même s’il fait partie du portefeuille de la Santé, le CEPMB, en raison de ses responsabilités quasi judiciaires, exerce son mandat en toute indépendance vis-à-vis du ministre de la Santé, qui est responsable de l’application des dispositions de la Loi se rapportant au Conseil. Il fonctionne également d’une façon indépendante des autres organismes, à savoir Santé Canada, qui autorise la vente des médicaments au Canada après avoir vérifié leur innocuité, leur efficacité et leur qualité; les régimes publics fédéral, provinciaux et territoriaux d’assurance-médicaments qui autorisent l’inscription des médicaments sur leurs formulaires de médicaments admissibles à un remboursement; et le Programme commun d’examen des médicaments, géré par l’Association canadienne des médicaments et des technologies de la santé (ACMTS), qui présente des recommandations quant aux médicaments admissibles au remboursement par les régimes publics d’assurance-médicaments participants.
Le CEPMB se compose du personnel du Conseil, soit des fonctionnaires responsables des activités quotidiennes de l’organisme, et de membres du Conseil nommés par le gouverneur en conseil, qui agiront en cas de conflit entre le personnel du Conseil et un breveté au sujet du prix d’un médicament breveté.
Compétence
Réglementation
Le CEPMB réglemente les prix plafonds « départ usine » de tous les produits médicamenteux brevetés vendus au Canada, soit le prix auquel les brevetés (entreprises) vendent leurs produits aux grossistes, aux hôpitaux, aux pharmacies et aux autres grands distributeurs. Le CEPMB n’a aucun droit de regard sur les prix pratiqués dans le reste de la chaîne d’approvisionnement, par exemple les prix de gros ou de détail pratiqués par les pharmacies, et n’est pas habileté à réglementer les prix des médicaments non brevetés.
La compétence du CEPMB ne s’applique pas exclusivement aux produits médicamenteux dont le brevet porte sur l’ingrédient actif, mais aussi aux médicaments auxquels un brevet est lié, que ce soit au niveau de son procédé de fabrication, de son mode d’administration, de sa forme posologique, de l’indication/utilisation, de la préparation ou autre.
En vertu de la Loi, les brevetés (ce qui inclut toutes les parties qui bénéficient d’un brevet, qu’elles soient détentrices du brevet ou titulaires d’une licence délivrée en vertu du brevet, peu importe si leurs activités commerciales concernent un médicament de marque ou un médicament générique) doivent informer le CEPMB de leur intention de vendre un nouveau produit médicamenteux breveté. Les brevetés doivent présenter des renseignements relatifs au prix et à la vente après l’introduction de leur produit et ce, jusqu'à ce que tous les brevets liés soient expirés. Même s’ils ne sont pas tenus de faire approuver au préalable les prix de vente de leurs produits médicamenteux, les brevetés doivent respecter à la lettre les dispositions de la Loi pour s’assurer que les prix auxquels ils vendent leurs produits médicamenteux au Canada ne sont pas excessifs.
Le personnel du Conseil examine les prix demandés par les brevetés pour chaque concentration et forme d’un médicament breveté. S’il détermine qu’un prix est excessif, le personnel tâchera d’abord de trouver un consensus avec le breveté. À défaut d’y parvenir, le président peut tenir une audience. Lors de cette dernière, un panel, se composant des membres du Conseil, agira à titre d’arbitre neutre entre le personnel du Conseil et le breveté. Si ce panel conclut que le prix du médicament breveté est excessif, il peut rendre une ordonnance demandant la réduction du prix. Il peut également exiger que le breveté rembourse les recettes excessives qu’il a encaissées au gouvernement du Canada et, dans les cas où le panel conclut à la présence d’une politique de prix excessifs, il peut doubler le montant des recettes excessives à rembourser.
Rapport
Le CEPMB est une source fiable et impartiale de renseignements sur les prix des médicaments, les tendances pharmaceutiques et les investissements en recherche et développement. Chaque année, le CEPMB rend compte au Parlement, par le truchement du ministre de la Santé, de ses activités d’examen des prix et des prix des médicaments brevetés, présente une analyse des tendances des prix de tous les médicaments sur ordonnance et fait rapport des dépenses de R-D déclarées par les brevetés, comme l’exige la Loi.
Au moyen de l’initiative du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), établie par les ministres fédéral, provinciaux et territoriaux (FPT) de la Santé en 2001, le CEPMB effectue des analyses critiques des tendances des prix des produits médicamenteux d’ordonnance, de l’utilisation faite de ces produits et des coûts en produits médicamenteux brevetés et non brevetés. Le CEPMB publie les résultats des analyses du SNIUMP sous forme de rapports de recherche, d’affiches, de présentations et de résumés. Cette initiative permet aux gouvernements FPT et aux autres intervenants intéressés d’accéder à une source centrale et fiable de renseignements sur les tendances concernant les produits pharmaceutiques.
Entre autres initiatives, le CEPMB organise également un forum annuel de chercheurs avec des universitaires et des experts en matière de politiques afin de discuter de la recherche actuelle relativement à utilisation de produits pharmaceutiques au Canada et de domaines émergents pour des études futures.
Communications et liaison
Au cours de la dernière année, le CEPMB a continué d’intensifier ses activités et d’adopter une approche proactive relativement à sa présence dans les médias traditionnels et les médias sociaux. Il a notamment publié des communiqués, lancé des campagnes ciblées sur les médias sociaux, collaboré directement avec le public et donné des entrevues dans divers médias canadiens et internationaux, comme la CBC, la CPAC, le Globe and Mail, le Wall Street Journal et le CBS. Le CEPMB a apporté des améliorations à son site Web et à ses publications au chapitre de la clarté du langage et de l’accessibilité du contenu et continue de répondre aux demandes du public et d’informer ce dernier en publiant des mises à jour sur les délibérations et les décisions du Conseil ainsi que les résultats de recherche.
Le CEPMB s’est engagé à veiller à ce que les intervenants soient consultés et avisés de tout changement apporté à l’environnement opérationnel et informés rapidement de toute mise à jour du processus réglementaire. Au cours de la dernière année, la Direction de la réglementation et de la liaison auprès des brevetés a continué d’offrir régulièrement des séances de sensibilisation aux brevetés.
Gouvernance
Le Conseil est composé d’au plus cinq membres siégeant à temps partiel, dont un président et un vice-président. Tous les membres du Conseil sont nommés par le gouverneur en conseil. En vertu de la Loi, le président du Conseil assume également les fonctions de chef de la direction et, en cette qualité, est chargé de la gouverne et de la supervision des activités du CEPMB.
Les membres du Conseil sont collectivement responsables de la mise en œuvre des dispositions applicables de la Loi. Ensemble, ils approuvent les lignes directrices, les règles, les règlements administratifs et les autres politiques du Conseil, comme le prévoit la Loi et consultent au besoin des intervenants, y compris les ministres provinciaux et territoriaux de la Santé et les représentants de groupes de consommateurs et de l’industrie pharmaceutique.
Membres du Conseil
Présidente
Mary Catherine Lindberg, B. Sc. Pharm.

Mary Catherine Lindberg a été nommée membre et vice-présidente du Conseil d’examen du prix des médicaments brevetés en juin 2006 et présidente du Conseil en mars 2011. Son second et dernier mandat à titre de membre du Conseil se terminera en juin 2016.
Mme Lindberg a occupé de 2002 à 2009 le poste de directrice exécutive du Ontario Council of Academic Hospitals, un regroupement de 25 hôpitaux universitaires affiliés à une université et à sa faculté de médecine. Avant d’occuper ce poste, Mme Lindberg était sous-ministre adjointe des Services de santé, au ministère de la Santé et des Soins de longue durée de l’Ontario. Elle s’occupait entre autres du Régime d’assurance-maladie de l’Ontario et des Programmes de médicaments.
Mme Lindberg a fait ses études en pharmacie à l’Université de la Saskatchewan et a son permis de pratique en Saskatchewan et en Ontario.
Vice-président
Mitchell Levine, B. Sc., M. Sc., M. D., FRCPC, FISPE

Le Dr Mitchell Levine a été nommé membre et vice-président du Conseil le 3 mars 2011.
Le Dr Levine est professeur au sein des départements de médecine et d’épidémiologie clinique et biostatistiques, à la faculté des sciences de la santé de l’Université McMaster à Hamilton, en Ontario. Il est également directeur du Centre for Evaluation of Medicines à St. Joseph’s Healthcare, à Hamilton.
Le Dr Levine a obtenu son diplôme en médecine à l’Université de Calgary et a fait des études supérieures en médecine interne et en pharmacologie clinique à l’Université de Toronto. Il a obtenu un diplôme de maîtrise ès sciences en épidémiologie clinique de l’Université McMaster.
Avant sa nomination au Conseil, le Dr Levine était membre du Groupe consultatif sur les médicaments pour usage humain du CEPMB. Il agit actuellement comme consultant spécial en pharmacologie clinique au ministère de la Santé et des Soins de longue durée de l’Ontario. De plus, il est rédacteur en chef du Journal de la thérapeutique des populations et de la pharmacologie clinique et est corédacteur de l’ACP Journal Club : Evidence-Based Medicine.
Membres
Normand Tremblay, ASC, M.Sc., Adm.A., CMC

Normand Tremblay a été nommé Membre du Conseil le 31 mai 2012.
M. Tremblay agit à titre de Président et Chef de la direction d’une entreprise innovante (diaMentis inc.) qui s’affaire à mettre au point un outil d’aide au diagnostic en santé mentale et enseigne à l’Université du Québec dans le domaine de la gestion, de la gestion de projet et de l’innovation. Il fait bénéficier le Conseil d’une vaste expérience et expertise en planification stratégique et opérationnelle. M. Tremblay a été actif pendant plus de 20 ans dans le domaine des affaires dans différents secteurs d’activités, et ce sur l’échiquier national et international. Il a aussi siégé à des comités d’investissements et à plusieurs conseils d’administration, dont celui du Conseil national de recherches du Canada (CNRC) de 2007 à 2010. Il est titulaire d’une maîtrise en gestion de projet (M. Sc.) avec spécialisation en pratiques exemplaires pour le développement de produits de l’Université du Québec à Trois-Rivières et d’un certificat en gouvernance de sociétés de l’Université Laval et est consultant certifié en gestion. Il est aussi membre de l’Ordre des Administrateurs du Québec.
Richard Bogoroch, LL.B.

Richard Bogoroch a été nommé membre du Conseil le 13 décembre 2012.
M. Bogoroch est un avocat dans le domaine des blessures personnelles et des fautes professionnelles médicales qui est engagé activement dans le milieu juridique. Il est un ancien directeur de l’Ontario Centre for Advocacy Training et de l’Advocates’ Society. Il est également membre de la Toronto Lawyers Association, de la Medico-Legal Society of Toronto, de l’Association of Trial Lawyers of America, de l’American Bar Association, de l’Advocates’ Society et de l’Ontario Trial Lawyers Association. M. Bogoroch a donné de nombreux exposés et écrit bon nombre de documents sur les diverses facettes du contentieux des blessures personnelles et des fautes professionnelles médicales dans le cadre des programmes de formation juridique permanente offerts par le Barreau du Haut-Canada, l’Advocates’ Society, l’Osgoode Hall Law School et d’autres organisations.
M. Bogoroch a obtenu en 1978 un baccalauréat en droit civil (LL.L.) et en 1979 un baccalauréat en droit (LL.B.) de la Faculté de droit de l’Université McGill. Il a été reçu au Barreau de l’Alberta en 1980 et admis au Barreau de l’Ontario en 1983. En 1993, il a été accrédité par le Barreau du Haut-Canada comme spécialiste en contentieux des affaires civiles.
Carolyn Kobernick, LL. L., LL. B.

Carolyn Kobernick a été nommée membre du Conseil le 13 juin 2014.
Mme Kobernick est avocate et ancienne fonctionnaire. Avant sa retraite en 2013, elle occupait le poste de sous-ministre adjointe du droit public au sein du ministère de la Justice. En tant qu’avocate principale du ministre de la Justice et du procureur général du Canada, Mme Kobernick a joué un rôle clé dans l’élaboration et la mise en œuvre de politiques du secteur du droit public. En plus de cerner les grandes questions stratégiques, juridiques et opérationnelles, elle s’est attaquée à des questions intersectorielles nationales à titre d’agente de liaison entre le ministère de la Justice et les autres organismes gouvernementaux.
Mme Kobernick s’est jointe au ministère de la Justice en 1980, où elle a pratiqué le droit litigieux et fiscal dans le bureau régional de Toronto. En 1991, elle a été nommée avocate générale principale et chef adjointe du portefeuille du droit des affaires et du droit réglementaire après avoir travaillé pendant plus de dix ans au sein de l’unité des services juridiques de Service correctionnel du Canada. En tant qu’avocate principale générale, Mme Kobernick a participé à des dossiers stratégiques et opérationnels complexes du gouvernement fédéral, comme les projets de pipeline de l’Alaska et de pipeline de la vallée du Mackenzie ainsi que le dossier des commandites.
Pendant sa carrière au sein de la fonction publique, Mme Kobernick a activement participé à de nombreuses initiatives de haut niveau. Elle a été présidente du Comité national de conseils juridiques et championne ministérielle des Autochtones et de l’égalité entre les sexes. Elle a aussi agi à titre de haute fonctionnaire du ministère de la Justice au Comité du Cabinet chargé des affaires intérieures et a été nommée conseillère juridique principale auprès du gouvernement du Canada dans le cadre de l’enquête sur les commandites de 2004.
Mme Kobernick possède un B.C.L. et un LL.B. de l’Université McGill et a été reçue au barreau de l’Ontario. En 2012, elle a obtenu un certificat en arbitrage auprès des conseils d’administration et des tribunaux de l’Osgoode Hall Law School et de la Society of Ontario Adjudicators and Regulators.
Structure organisationnelle et personnel
Organigramme du CEPMB
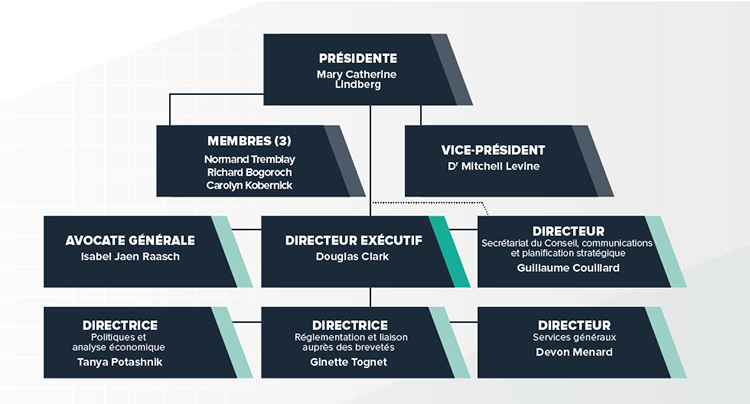
Description de la figure
L’organigramme illustre la structure hiérarchique de haut niveau au sein du CEPMB, et nomme les membres actuels du Conseil et de la haute direction. Conseil : Présidente—Mary Catherine Lindberg; Vice-président—Dr. Mitchell Levine; Membres—Normand Tremblay, Richard Bogoroch et Carolyn Kobernick. Haute direction : Directeur exécutif—Douglas Clark; Avocate générale— Isabel Jaen Raasch; Directeur, Secrétariat du Conseil, communications et planification stratégique—Guillaume Couillard; Directrice, Politiques et analyse économique—Tanya Potashnik; Directrice, Réglementation et liaison auprès des brevetés—Ginette Tognet; Directeur, Services généraux — Devon Menard.
Directeur exécutif
Le directeur exécutif avise le Conseil, supervise le travail du personnel et en assume le leadership.
Réglementation et liaison auprès des brevetés
La Direction de la réglementation et de la liaison auprès des brevetés fait l’examen des prix des produits médicamenteux brevetés vendus au Canada pour s’assurer qu’ils ne sont pas excessifs. De plus, elle encourage les brevetés à se conformer volontairement aux Lignes directrices du Conseil, veille à la bonne application des politiques de conformité et fait enquête sur les plaintes reçues concernant les prix de certains produits médicamenteux brevetés. De plus, la Direction sensibilise les brevetés sur les Lignes directrices du Conseil et les informe de leurs obligations en matière de présentation de rapports.
Politiques et analyse économique
La Direction des politiques et de l’analyse économique formule des avis politiques et stratégiques; présente des recommandations concernant des modifications éventuelles aux Lignes directrices du Conseil; effectue des recherches et des analyses sur les prix des médicaments, les évolutions sur le marché pharmaceutique et les tendances en matière de recherche et développement; et publie des études visant à fournir aux gouvernements FPT et à d’autres intervenants de l’information crédible et centralisée à l’appui de politiques fondées sur des données probantes.
Services généraux
La Direction des services généraux offre conseils et services en matière de gestion des ressources humaines, des installations, de la santé et sécurité au travail, de la technologie et de la gestion de l’information. Elle s’occupe également de la planification financière de même que des rapports, des vérifications, de l’évaluation et de la liaison auprès des agences centrales fédérales compétentes relativement à ces questions.
Secrétariat du Conseil, communications et planification stratégique
La Direction du Secrétariat du Conseil, communications et planification stratégique planifie et orchestre le programme des communications du CEPMB, les relations avec les médias et le suivi aux demandes de renseignements du public. Elle gère les réunions et les audiences du Conseil, dont les dossiers de procédure. Elle coordonne les activités du Conseil relatives à l’application de la Loi sur l’accès à l’information et de la Loi sur la protection des renseignements personnels. Finalement, elle est responsable du processus de planification stratégique et de production de rapports.
Avocate générale
L’avocate générale fournit des opinions juridiques au CEPMB et dirige l’équipe de la poursuite dans les audiences du Conseil.
Budget
En 2015-2016, le Conseil disposait d’un budget de 10,945 millions de dollars et d’un effectif approuvé de 71 équivalents temps plein (ETP).
Tableau 1. Budget et effectif
|
2014-2015 |
2015-2016 |
2016-2017 |
| Budget |
10,927 M$ |
10,945 M$ |
10,965 M$ |
| Salaires |
6,903 M$ |
6,937 M$ |
6,963 M$ |
| Opérations |
1,554 M$ |
1,538 M$ |
1,532 M$ |
| Affectation à but spécial* |
2,470 M$ |
2,470 M$ |
2,470 M$ |
| Équivalents temps plein (ETP) |
73 |
71 |
71 |
* L’affectation à but spécial est réservée aux coûts externes liés à la tenue d’audiences publiques (conseillers juridiques, témoins experts, etc.). Les fonds non dépensés sont retournés au Trésor.
Réglementation des prix des médicaments brevetés : une vigilance continue nécessaire
Avec une population qui vieillit et qui utilise davantage de médicaments sur ordonnance (et parfois certains types de médicaments plus dispendieux), les dépenses du Canada en produits pharmaceutiques devraient augmenter considérablement au cours des prochaines années. Certaines avancées médicales ont permis d’offrir sur le marché canadien de nombreux nouveaux médicaments novateurs plus efficaces pour remplacer les traitements existants et traiter des conditions qui étaient jadis considérées intraitables. Ces nouveaux médicaments incluent les médicaments orphelins à coût élevé, les produits biologiques et les médicaments contre le cancer. Le CEPMB joue un rôle important en réglementant les prix des produits médicamenteux brevetés nouveaux et existants, afin d’assurer la viabilité du système de santé canadien.
Prix 28 % plus élevés
En 2015, les prix canadiens étaient 28 % supérieurs au prix médian de l’OCDE
Les prix au Canada sont parmi les plus élevés au monde. À la lumière de sources de données indépendantes, tous les autres pays qui servent de points de comparaison au CEPMB (à l’exception des É.-U.) ont des prix inférieurs (en moyenne) à ceux du Canada.
157 millions de dollars en recettes excessives ont été recouvrés
157 millions de dollars en recettes excessives ont été recouvrés par le CEPMB depuis 1993 au moyen d’engagements de conformité volontaire et d’ordonnance du Conseil. En 2015, suite aux enquêtes du CEPMB, 5 engagements de conformité volontaire ont été acceptés, et des recettes excessives de 7,1 millions de dollars ont été remboursées au moyen de paiements au gouvernement du Canada.
Avis d’audience
Trois audiences sont actuellement devant le Conseil.
Outre l’affaire Soliris (Alexion), des avis d’audience ont été émis en février et en mars 2016 afin de déterminer si Galderma Canada Inc. et Baxalta Canada Corporation ont fait défaut de présenter au CEPMB les renseignements sur les prix et les ventes exigés en vertu de la Loi sur les brevets et du Règlement sur les médicaments brevetés. Les audiences sont prévues à l’automne 2016.
Le CEPMB protège les intérêts des consommateurs canadiens en s’assurant que les produits médicamenteux brevetés ne sont pas vendus au Canada à des prix excessifs. Il le fait en examinant les prix auxquels les brevetés vendent chaque produit médicamenteux breveté aux grossistes, aux hôpitaux et aux pharmacies et en prenant des mesures afin de veiller à ce que les brevetés réduisent leurs prix et remboursent leurs recettes excessives, le cas échéant.
Exigences en matière de rapport
Les brevetés sont tenus par la loi de produire des renseignements relatifs à la vente de leurs produits médicamenteux au Canada. La Loi sur les brevets (la Loi) et le Règlement sur les médicaments brevetés (le Règlement) dictent les rapports que doivent soumettre les brevetés, et le personnel du Conseil examine de façon continue les renseignements sur les prix afin de s’assurer que les prix ne sont pas excessifs, et ce, jusqu’à échéance de tous les brevets applicables.
Il existe divers facteurs servant à déterminer si le prix d’un produit médicamenteux est excessif, comme l’énonce l’article 85 de la Loi. Le Compendium des politiques, des Lignes directrices et des procédures (les Lignes directrices) fournit des renseignements sur les tests appliqués aux prix par le personnel du Conseil pour décider si le prix auquel un breveté vend son produit est inférieur au prix maximal permis. Les Lignes directrices ont été élaborées en collaboration avec les intervenants, dont les ministres de la Santé provinciaux et territoriaux, les associations de consommateurs et l’industrie pharmaceutique. Lorsque, à l’issue d’une enquête, on juge qu’il y a un problème relativement au prix d’un produit médicamenteux breveté, on offre au breveté la possibilité de réduire volontairement son prix et (ou) de rembourser ses recettes excessives aux termes des modalités d’un engagement de conformité volontaire. Si le breveté ne souscrit pas aux résultats de l’enquête et choisit de ne pas présenter un tel engagement, la présidente du Conseil peut émettre un avis d’audience. Après l’audition de la preuve, si le Conseil conclut que le prix est excessif, il peut rendre une ordonnance obligeant le breveté à réduire le prix de son produit et (ou) à rembourser les recettes excessives. Le breveté peut également soumettre un engagement de conformité volontaire après l’émission d’un avis d’audience afin de résoudre l’affaire. Des copies de la Loi, du Règlement, des Lignes directrices et du Guide du breveté sont affichées sur le site Web du CEPMB.
Défaut de présenter ses rapports
Le CEPMB compte sur la ponctualité des brevetés en ce qui a trait à la présentation de leurs rapports sur tous les produits médicamenteux brevetés qu’ils vendent au Canada auxquels un brevet s’applique. En 2015, un produit médicamenteux breveté et vendu avant 2015 a été déclaré au CEPMB pour la première fois, et 11 produits médicamenteux déclarés antérieurement au CEPMB et dont le brevet était arrivé à échéance ont de nouveau été déclarés comme ayant un brevet applicable. Le tableau 2 présente les produits médicamenteux qui étaient brevetés et vendus au Canada avant de faire l’objet d’un rapport au CEPMB. De plus, suite à une vérification relative aux brevets, GlaxoSmithKline a déclaré des brevets liés à 81 DIN (numéros d’identification du médicament), dont 68 n’avaient jamais été déclarés au CEPMB et 13 avaient déjà été déclarés. Les renseignements réglementaires relatifs à ces DIN sont en cours de traitement et les DIN en question ne sont pas inclus dans le présent rapport annuel.
Tableau 2. Défaut de présenter ses rapports sur les ventes de produits médicamenteux brevetés
| Actuellement vendu par |
Nom de marque |
Nom générique |
Année où le médicament est devenu assujetti à la compétence du conseil |
Année où le médicament est devenu assujetti à la compétence du Conseil en vertu d’un brevet subséquent |
| Merck Canada Inc. |
Puregon
(1 DIN) |
Follitropine bêta |
2001 |
blank |
| Janssen |
Risperdal
(6 DIN) |
Rispéridone |
1993 |
2007 |
| Janssen |
Risperdal M
(5 DIN) |
Rispéridone |
2003 |
2007 |
Défaut de présenter les données sur les prix et sur les ventes (formulaire 2)
Le défaut de présenter ses rapports fait référence au défaut partiel ou complet d’un breveté de soumettre les rapports qu’il est tenu de présenter en vertu de la Loi et du Règlement. Le Conseil n’a pas été appelé à rendre des ordonnances pour défaut de présenter ses rapports en 2015.
Examen scientifique
Groupe consultatif sur les médicaments pour usage humain
Tous les nouveaux produits médicamenteux brevetés ayant fait l’objet d’un rapport au CEPMB sont soumis à une évaluation scientifique dans le cadre du processus d’examen du prix. Le Groupe consultatif sur les médicaments pour usage humain (GCMUH) a été créé par le Conseil dans le but d’offrir une expertise et des conseils indépendants au personnel du Conseil. Le GCMUH entreprend un examen lorsqu’un breveté présente une demande relative à l’amélioration thérapeutique. De plus, les membres du groupe examinent et évaluent les renseignements scientifiques pertinents et disponibles, notamment toute preuve présentée par le breveté quant au niveau d’amélioration thérapeutique proposé, le choix de produits médicamenteux aux fins de comparaison et les posologies comparables.
Examen du prix
Le CEPMB examine le prix moyen de chaque concentration et de chaque forme posologique d’un médicament breveté. Dans la plupart des cas, cette unité est conforme au numéro d’identification du médicament (DIN) attribué par Santé Canada au moment où la vente au Canada du médicament est approuvée.
Nouveaux produits médicamenteux brevetés ayant fait l’objet d’un rapport au CEPMB en 2015
Aux fins du présent rapport, tout produit médicamenteux breveté lancé ou vendu sur le marché canadien avant l’attribution de son premier brevet entre le 1er décembre 2014 et le 30 novembre 2015 est réputé avoir été breveté en 2015.
Il y a eu 86 nouveaux produits médicamenteux brevetés pour usage humain ayant été rapportés comme vendus en 2015. Certains constituent une ou plusieurs concentrations d’une nouvelle substance active et d’autres, de nouvelles présentations de médicaments existants. Un des 86 nouveaux produits médicamenteux brevetés a été commercialisé au Canada avant d’avoir obtenu le brevet canadien qui l’a assujetti à la compétence du CEPMB. Le tableau qui suit indique l’année de la première commercialisation de ces produits médicamenteux.
Tableau 3. Nombre de nouveaux produits médicamenteux brevetés pour usage humain en 2015 selon l’année de leur première vente
| Année de la première vente |
Nombre de produits médicamenteux |
| 2015 |
85 |
| 2013 |
1 |
| Total |
86 |
La liste des nouveaux produits médicamenteux brevetés ayant fait l’objet d’un rapport au CEPMB est affichée sur le site Web. Cette liste présente de l’information sur l’état d’avancement de l’examen (p. ex. la question de savoir si le prix du médicament est sous examen, conforme aux Lignes directrices, sous enquête ou assujetti à un engagement de conformité volontaire ou à un avis d’audience).
La figure 1 illustre le nombre de nouveaux produits médicamenteux brevetés pour usage humain ayant fait l’objet d’un rapport au CEPMB de 1989 à 2015.
Figure 1. Nouveaux produits médicamenteux brevetés pour usage humain
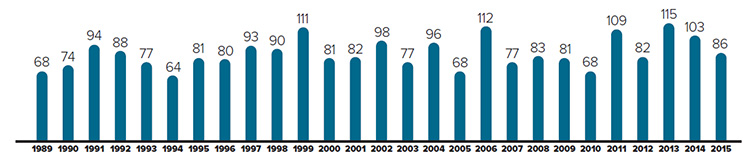
Description de la figure
Il s’agit d’un diagramme à barres présentant le nombre de nouveaux produits médicamenteux brevetés à usage humain déclarés au CEPMB selon l'année. En 1989, 68 produits médicamenteux brevetés à usage humain ont été déclarés au CEPMB.
1990 : ;74; 1991 : 94; 1992 : 88; 1993 : 77; 1994 : 64; 1995 : 81; 1996 : 80; 1997 : 93; 1998 : 90; 1999 : 111; 2000 : 81; 2001 : 82; 2002 : 98; 2003 : 77; 2004 : 96; 2005 : 68; 2006 : 112; 2007 : 77; 2008 : 83; 2009 : 81; 2010 : 68; 2011 : 109; 2012 : 82; 2013 : 115; 2014 : 103 ; 2015 : 86.
Des 86 nouveaux produits médicamenteux brevetés :
- les prix de 57 produits avaient été soumis à un examen en date du 31 mars 2016 :
- les prix de 38 produits médicamenteux brevetés ont été jugés conformes aux Lignes directrices;
- les prix de 11 produits médicamenteux brevetés semblaient excessifs aux termes des Lignes directrices d’un montant ne justifiant pas d’enquête;
- les prix de 7 produits médicamenteux brevetés semblaient excessifs aux termes des Lignes directrices; ainsi, des enquêtes ont été lancées;
- un produit a fait l’objet d’un engagement de conformité volontaire.
Pour la liste complète des 86 nouveaux produits médicamenteux brevetés, y compris l’état d’avancement de l’examen de leur prix, veuillez consulter l’Annexe 2.
Examen des prix des produits médicamenteux brevetés existants pour usage humain en 2015
Aux fins du présent rapport, l’expression « produits médicamenteux brevetés existants » désigne tous les produits médicamenteux brevetés vendus sur le marché canadien et ayant fait l’objet d’un rapport au CEPMB avant le 1er décembre 2014.
Au moment de la rédaction du présent rapport, il y avait 1 273 produits médicamenteux brevetés existants :
- les prix de 922 produits médicamenteux brevetés étaient conformes aux Lignes directrices;
- les prix de 254 produits médicamenteux brevetés étaient excessifs aux termes des Lignes directrices d’un montant ne justifiant pas d’enquête;
- les prix de 86 produits médicamenteux brevetés existants faisaient l’objet d’une enquête :
- 2 enquêtes provoquées par le prix de lancement en 2012;
- 4 enquêtes provoquées par le prix de lancement en 2013;
- 4 enquêtes provoquées par le prix de lancement en 2014;
- 76 enquêtes lancées en fonction des prix annuels.
- le prix d’un produit médicamenteux était sous examen;
- les prix de 9 produits médicamenteux ont fait l’objet d’engagements de
conformite volontaire;
- un produit médicamenteux fait l’objet d’une audience;
- un autre produit médicamenteux fait toujours l’objet d’une audience, même s’il n’était plus breveté en 2015
Un aperçu de l’état d’avancement de l’examen du prix des produits médicamenteux brevetés pour usage humain nouveaux et existants en 2015 est présenté au tableau 4.
Tableau 4. Produits médicamenteux brevetés pour usage humain vendus en 2015 – État d’avancement de l’examen du prix au 31 mars 2016
|
Nouveaux produits médicamenteux lancés sur le marché en 2015 |
Produits médicamenteux existants |
Total |
| Total |
86 |
1 273 |
1 359 |
| Conformes aux Lignes directrices |
38 |
922 |
960 |
| Sous examen |
29 |
1 |
30 |
| Ne justifient pas d’enquête |
11 |
254 |
265 |
| Sous enquête |
7 |
86 |
93 |
| Engagements de conformité volontaire |
1 |
9 |
10 |
| Audiences sur le prix |
|
1 |
1 |
Mise à jour du rapport annuel 2014
- L’examen de l’ensemble des produits médicamenteux pour usage humain ayant fait l’objet d’un rapport « sous examen » dans le rapport annuel de 2014 est terminé.
- Des 61 enquêtes mentionnées dans le rapport annuel de 2014, 34 d’entre elles se sont soldées par les résultats suivants :
- la fermeture de l’enquête lorsqu’il apparaît que le prix est conforme aux Lignes directrices;
- un engagement de conformité volontaire par lequel le breveté s’engage à réduire le prix de son produit et à rembourser les recettes excessives au moyen d’un paiement et (ou) d’une réduction du prix d’un autre produit médicamenteux breveté (voir la section « Engagements de conformité volontaire »);
- une audience publique dont l’objet est de déterminer si le prix du produit médicamenteux est ou non excessif, y compris une ordonnance corrective rendue par le Conseil (voir la section « Audiences »).
Produits médicamenteux brevetés en vente libre et produits médicamenteux brevetés pour usage vétérinaire
Le personnel du Conseil fait l’examen des prix des produits médicamenteux brevetés en vente libre et des produits médicamenteux brevetés pour usage vétérinaire à la suite de la réception d’une plainte. Aucune plainte n’a été reçue en 2015.
Engagements de conformité volontaire et audiences
Engagements de conformité volontaire
L’engagement de conformité volontaire est un engagement écrit par lequel le breveté s’engage à rendre le prix de son produit médicamenteux conforme aux Lignes directrices du Conseil. En vertu des Lignes directrices, les brevetés peuvent soumettre un engagement de conformité volontaire lorsque le personnel du Conseil détermine, à la suite d’une enquête, que le prix auquel le produit médicamenteux breveté est vendu par le breveté au Canada semble excessif aux termes des Lignes directrices. Un engagement de conformité volontaire représente un compromis entre le CEPMB et le breveté suite à des négociations entre les parties à la lumière des faits précis et du contexte d’un cas particulier. Par conséquent, l’engagement de conformité volontaire n’a aucune valeur de précédent. Le breveté peut également soumettre un engagement de conformité volontaire après l’émission d’un avis d’audience.
En 2015, cinq engagements de conformité volontaire ont été acceptés. En plus de la réduction du prix de certains produits médicamenteux, des recettes excessives totalisant 7 087 235,86 $ ont été remboursées au moyen de paiements versés au gouvernement du Canada.
En date du 31 mai 2016, la présidente a accepté six engagements de conformité volontaire dans les affaires Mitosol, Neoral, Apprilon, Angiomax, Samsca et Actimmune; par conséquent, des recettes excessives totalisant 975 589,26 $ ont été remboursées au moyen de paiements versés au gouvernement du Canada.
Les brevetés doivent s’assurer que les prix de leurs produits médicamenteux brevetés sont conformes aux Lignes directrices du Conseil, et ce, au cours de toutes les périodes où les produits médicamenteux relèvent de la compétence du CEPMB.
Tableau 5. Engagements de conformité volontaire en 2015 et jusqu’au 31 mai 2016
| Produit médicamenteux breveté |
Usage thérapeutique |
Breveté |
Date d’approbation |
Remboursement des recettes excessives |
| Réduction de prix |
Paiement au gouvernement |
| Engagements de conformité volontaire en 2015 |
Crixivan
(1 produit médicamenteux)* |
Traitement de l’infection à VIH |
Merck Canada Inc. |
Avril |
blank |
58 917,68 $ |
Carnitor IV
(1 produit médicamenteux) |
Prévention et traitement de la carence en carnitine chez les patients atteints d’insuffisance rénale terminale |
Sigma-Tau Pharmaceuticals Inc. |
Août |
blank |
5 688 632,64 $ |
Loprox
(1 produit médicamenteux) |
Traitement topique d’infections cutanées |
Valeant Canada LP |
Octobre |
✔ |
23 947,35 $ |
Dificid
(1 produit médicamenteux) |
Traitement des infections à Clostridium difficile (ICD) |
Merck Canada Inc. |
Novembre |
✔ |
400 000,00 $ |
Zaxine
(1 produit médicamenteux) |
Réduction des risques de récidive de l’encéphalopathie hépatique (EH) |
Salix Pharmaceuticals Inc. |
Décembre |
✔ |
915 738,19 $ |
| Total |
|
|
|
|
7 087 235,86 $ |
| Engagements de conformité volontaire en 2016, jusqu’au 31 mai |
Mitosol
(1 produit médicamenteux) |
Complément à la chirurgie du glaucome externe |
Labtician Ophthalmics Inc. |
Janvier |
✔ |
190,58 $ |
Neoral
(1 produit médicamenteux)* |
Prévention du rejet de greffe après une transplantation d’organe solide et traitement du rejet de greffe |
Novartis Pharmaceuticals Canada Inc. |
Février |
✔ |
96 466,51 $ |
Apprilon
(1 produit médicamenteux) |
Traitement de lésions inflammatoires isolées (papules et pustules) et de la rosacée chez les patients adultes |
Galderma Canada Inc. |
Mars |
✔ |
blank |
Angiomax
(1 produit médicamenteux) |
Traitement anticoagulant chez les patients qui subissent une opération coronaire percutanée et chez les patients à risque modéré ou élevé de syndrome coronarien aigu en raison d’angine instable ou d’infarctus du myocarde sans élévation du segment ST pour lesquels on prévoit une opération coronaire percutanée précoce |
Sunovion Pharmaceuticals Canada Inc. |
Mars |
✔ |
88 412,60 $ |
Samsca
(2 produits médicamenteux) |
Traitement de l’hyponatrémie non hypovolémique cliniquement importante |
Otsuka Canada Pharmaceutical Inc. |
Mai |
✔ |
200 000,00 $ |
Actimmune
(1 produits médicamenteux) |
Granulomatose septique chronique et ostéopétrose maligne grave |
Horizon Pharma Ireland Limited |
Mai |
✔ |
590 519,57 $ |
| Grand
total
|
|
|
|
|
8 062 825,12 $ |
* N’étant plus brevetés en 2015, ces produits médicamenteux n’ont pas été comptés dans les engagements de conformité volontaire du Tableau 4 – Produits médicamenteux brevetés pour usage humain vendus en 2015.
Audiences
Le CEPMB tient des audiences dans deux types d’instances :
- prix excessifs;
- défaut de présenter ses rapports (questions relatives à la compétence du Conseil).
Prix excessifs
Lorsque le prix d’un médicament breveté semble excessif, le Conseil peut tenir une audience publique et, s’il est démontré que le prix du produit médicamenteux est excessif, rendre une ordonnance obligeant le breveté à réduire le prix de son produit et à rembourser les recettes excessives qu’il a tirées de la vente de son produit à un prix excessif. On peut demander une révision judiciaire des décisions du Conseil devant la Cour fédérale du Canada.
En janvier 2015, le CEPMB a annoncé qu’il tiendrait une audience publique dans l’affaire du prix du médicament breveté Soliris et d’Alexion Pharmaceuticals Inc., la société pharmaceutique qui détient le brevet de Soliris et qui vend ce médicament au Canada. Soliris est le premier et le seul traitement pour l’hémoglobinurie paroxystique nocturne – une affection sanguine rare et potentiellement mortelle. Le but de cette audience sera de déterminer si le médicament a été ou est vendu sur le marché canadien à un prix qui, de l’avis du Conseil, est ou était excessif et, le cas échéant, de déterminer l’ordonnance qui doit être délivrée, s’il le faut, pour corriger le prix excessif. Actuellement, l’audience est prévue au cours des mois de janvier et février 2017.
Défaut de présenter ses rapports (questions relatives à la compétence du Conseil)
Si le personnel du Conseil constate qu’un breveté a omis ou refusé de fournir au CEPMB les renseignements relatifs à l’établissement des prix et à la valeur des ventes exigés par la Loi, il recommandera au président de convoquer une audience publique pour déterminer si le breveté est en fait tenu de se conformer aux exigences en matière de production de rapports de la Loi et du Règlement (c.-à-d. s’il est assujetti à la compétence du Conseil). Si le Panel du Conseil conclut, à l’issue de l’audience publique, que le breveté n’a pas respecté les exigences en matière de présentation de renseignements, il peut ordonner au breveté de fournir au CEPMB les renseignements nécessaires sur l’établissement des prix et la valeur des ventes.
À la suite de plaintes du public adressées au personnel du Conseil concernant le prix de deux produits médicamenteux, le CEPMB a annoncé en février et en mars 2016 qu’il organisera des audiences publiques distinctes afin de décider si Galderma Canada Inc. (Galderma) et Baxalta Canada Corporation (Baxalta) sont tenus de fournir au CEPMB les renseignements relatifs à l’établissement des prix et à la valeur des ventes prévus dans la Loi sur les brevets et le Règlement sur les médicaments brevetés. L’audience dans l’affaire Galderma se déroulera du 26 au 29 septembre 2016, et l’audience dans l’affaire Baxalta se déroulera du 15 au 17 et le 21 novembre 2016.
L’affaire Galderma est liée aux médicaments commercialisés sous les noms de marque Differin, Differin XP, TactuPump et TactuPump Forte dont Galderma détient le brevet. Ces médicaments sont généralement utilisés pour le traitement de l’acné.
L’affaire Baxalta est liée au médicament Oncaspar dont Baxalta détient le brevet. Oncaspar est vendu au Canada dans le cadre du Programme d’accès spécial de Santé Canada et est utilisé pour le traitement des patients atteints de leucémie aiguë lymphoblastique.
Le Conseil compte deux autres affaires dans son calendrier d’audiences : Apotex Inc. et Apo-Salvent exempt de CFC. Les résultats de ces affaires seront examinés à la lumière des décisions de la Cour d’appel fédérale dans les affaires de ratiopharm et Sandoz. En Janvier 2016, Sandoz Canada Inc. et ratiopharm Inc. (actuellement Teva Canada Limitée) ont déposé auprès de la Cour suprême du Canada une demande d’autorisation d’interjeter appel de l’arrêt de la Cour d’appel fédérale.
Sommaire
En 2015 et jusqu’au 31 mai 2016, des recettes excessives totalisant 8 062 825,12 $ ont été remboursées au moyen de paiements versés au gouvernement du Canada en vertu d’engagements de conformité volontaire et d’ordonnances du Conseil.
Depuis 1993, 113 engagements de conformité volontaire ont été approuvés et 29 audiences publiques ont été entamées. Ces mesures ont donné lieu à des réductions de prix et au remboursement des recettes excessives au moyen de réductions supplémentaires de prix ou de paiements versés au gouvernement du Canada. Plus de 157 millions de dollars ont été recueillis en vertu d’engagements de conformité volontaire et d’ordonnances du Conseil par l’entremise de paiements versés au gouvernement du Canada et (ou) aux clients, dont les hôpitaux et les cliniques médicales.
Affaires interjetées auprès de la Cour d’appel fédérale et de la Cour suprême du Canada
Le 6 novembre 2015, la Cour d’appel fédérale a rendu sa décision à l’égard des appels portant sur la compétence du CEPMB en ce qui a trait au salbutamol HFA, à d’autres produits de ratiopharm Inc. (actuellement Teva Canada Limitée) et à certains produits vendus au Canada par Sandoz Canada Inc.
La Cour d’appel a confirmé la décision initiale du Panel du Conseil selon laquelle Sandoz et ratiopharm sont des brevetés aux termes de l’article 79 de la Loi, car ils exercent des droits de vente pour leurs produits en vertu de licences octroyées par les propriétaires de certains brevets. Dans son interprétation large de l’article 79 de la Loi, la Cour d’appel fédérale a constaté que le libellé de la Loi qui porte sur le CEPMB doit être axé sur les personnes devant être protégées des prix excessifs (les consommateurs) plutôt que sur celles qui sont en mesure d’établir ces prix (les brevetés).
La décision a également confirmé la constitutionnalité des articles 79-103 de la Loi. À cet égard, la Cour d’appel fédérale a déterminé que le Conseil a à juste titre conclu que le contrôle des prix exigés pour les médicaments brevetés fait partie des pouvoirs conférés au Parlement relativement aux brevets en vertu du paragraphe 91(22) de la Loi constitutionnelle de 1867 en ce qui a trait aux titulaires de brevet, aux propriétaires de brevet ou à quiconque exerce des droits en vertu d’un brevet (par exemple les titulaires de licence).
Le libellé complet de la décision de la Cour d’appel fédérale se trouve sur le site Web de la Cour d’appel fédérale à l’adresse suivante : http://decisions.fca-caf.gc.ca/fca-caf/decisions/en/item/126361/index.do (en anglais seulement).
Tableau 6. État d’avancement des audiences devant le Conseil en 2015 et jusqu’au 31 mai 2016
Allégations de prix excessifs
| Produit médicamenteux breveté |
Indication/
Utilisation |
Breveté |
Date de l’avis d’audience |
État d’avancement |
| Apo-Salvent exempt de CFC |
Asthme |
Apotex Inc. |
8 juillet 2008 |
En cours |
| Soliris |
Hémoglobinurie paroxystique nocturne
Syndrome hémolytique et
urémique atypique
|
Alexion Pharmaceuticals Inc. |
20 janvier 2015 |
Conférence préparatoire à l’audience : 1er juin 2016
Audience :
27-30 juin 2016 et
4-8 juillet 2016 |
Allégations de défaut de soumettre ses rapports
| Produit médicamenteux breveté |
Indication/
Utilisation |
Breveté |
Date de l’avis d’audience |
État d’avancement |
| Tous les médicaments pour lesquels Apotex est un « breveté » |
blank |
Apotex Inc. |
3 mars 2008 |
En cours |
Differin
Differin XP
TactuPump
TactuPump Forte |
Acné |
Galderma Canada Inc. |
23 février 2016 |
Audience :
26-29 septembre 2016 |
| Oncaspar |
Leucémie aiguë lymphoblastique |
Baxalta Canada Corporation |
22 mars 2016 |
Audience :
15-17 et 21 novembre 2016 |
Révision judiciaires de décisions du Conseil et appels
| Produit médicamenteux breveté |
Indication/
Utilisation |
Breveté |
Enjeu |
Date de l'avis d'audience /
État d’avancement |
| ratio-Salbutamol HFA |
Asthme |
ratiopharm Inc. (actuellement Teva Canada Limitée) |
Allégations de prix excessifs |
18 juillet 2008
Demande d’autorisation d’appel déposée à la Cour suprême du Canada : le 5 janvier 2016 |
| ratiopharm Inc. (actuellement Teva Canada Limitée) |
Défaut de soumettre ses rapports (questions relatives à la compétence du Conseil) |
28 août 2008
Demande d’autorisation d’appel déposée à la Cour suprême du Canada : le 5 janvier 2016 |
| Sandoz Canada Inc. |
Défaut de soumettre ses rapports (questions relatives à la compétence du Conseil) |
8 mars 2010
Demande d’autorisation d’appel déposée à la Cour suprême du Canada : le 5 janvier 2016 |
| Soliris |
Hémoglobinurie paroxystique nocturne
Syndrome hémolytique et
urémique atypique
|
Alexion Pharmaceuticals Inc. |
Constitutionnalité du CEPMB |
20 janvier 2015
Requête en radiation accueillie en juin 2016 |
Sandoz Canada Inc. et ratiopharm Inc. (actuellement Teva Canada Limitée) ont déposé auprès de la Cour suprême une demande d’autorisation d’interjeter appel de l’arrêt de la Cour d’appel fédérale.
En juin 2015, l’entreprise Alexion a déposé une demande auprès de la Cour fédérale pour faire déclarer que les dispositions de la Loi sur les brevets permettant au CEPMB de réglementer les prix excessifs sont inconstitutionnelles parce qu’elles empiètent sur la compétence des provinces en matière de propriété et de droits civils. Le procureur général du Canada a déposé une requête pour rejeter la demande de révision judiciaire d’Alexion concernant la constitutionnalité des dispositions, demande entendue en janvier 2016 et accueillie en juin 2016. Alexion a aussi demandé une révision judiciaire de la décision du Conseil, qui a déterminé que le personnel du Conseil et sa présidente n’étaient pas en conflit d’intérêts dans cette affaire. L’affaire a été suspendue.
Principales tendances relatives aux produits pharmaceutiques : Les ventes de médicaments sont à la hausse
De nombreux facteurs influent sur les dépenses totales en produits pharmaceutiques, notamment les prix, l’utilisation, l’arrivée sur le marché de nouveaux médicaments plus coûteux, et la « substitution générique » d’anciens médicaments. En 2015, les ventes de médicaments brevetés avaient augmenté de 9,5 %, et les prix au Canada sont demeurés au troisième rang parmi tous les pays de comparaison du CEPMB (CEPMB7).
Ventes de produits médicamenteux brevetés de 15,2 G$
En 2015, la valeur des ventes de produits médicamenteux brevetés a atteint 15,2 milliards de dollars, par rapport à 13,8 milliards en 2014.
Il s’agit de la hausse la plus importante depuis 2003, équivalant à plus de deux fois tout taux de croissance annuel enregistré depuis 2006. De plus, la hausse sur douze mois de 1,4 milliard de dollars égale le record de la hausse la plus substantielle des ventes de médicaments brevetés dans l’histoire du Canada.
L’augmentation des prix des médicaments brevetés était inférieure à l’IPC
En 2015, l’augmentation moyenne des prix des médicaments brevetés était inférieure au taux d’inflation, tel que mesuré par l’Indice des prix à la consommation (IPC) et, par conséquent, n’a pas contribué à la croissance des ventes.
Les ventes d’antiinfectieux ont augmenté de 49,9 %
Les antiinfectieux généraux pour usage systémique ont eu la plus grande incidence sur l’augmentation des ventes en 2015.
Cette catégorie de médicaments, qui comprend de nouveaux traitements de pointe contre l’hépatite C, représente 15,8 % des ventes en 2015, soit une hausse de 49,9 % par rapport à l’année précédente.
Le Canada est parmi les 10 premiers marchés dans le monde
Le Canada est un marché important pour les produits pharmaceutiques et accapare 2 % des ventes mondiales. Le Canada figure constamment parmi les 10 premiers marchés dans le monde pour les produits pharmaceutiques. Malgré cela, les ratios moyens de R-D par rapport aux ventes sont 5 fois plus élevés parmi les pays de comparaison du CEPMB, alors que les prix dans la plupart de ces pays sont moins élevés.
Dépenses en médicaments au Canada 1,8 % du PIB
En 2013, les Canadiens et Canadiennes ont dépensé 1,8 % du produit intérieur brut sur des médicaments.
Il s’agit de la deuxième part la plus élevée du CEPMB7, seulement derrière les États-Unis.
Le CEPMB fait rapport des tendances observées au chapitre des ventes de produits pharmaceutiques et des prix de tous les médicaments, ainsi que des dépenses de recherche-développement des brevetés. De plus, il dirige des études et mène des analyses portant sur diverses questions relatives aux prix et aux coûts des produits pharmaceutiques.
Tendances relatives aux ventes de produits médicamenteux brevetés
En vertu du Règlement sur les médicaments brevetés, les brevetés doivent faire rapport en détail de leurs ventes de produits médicamenteux brevetés, à savoir les quantités vendues et les recettes nettes tirées des ventes de chaque produit médicamenteux, par catégorie de clients et par province ou territoire. Le CEPMB utilise ces éléments d’information dans ses analyses des tendances aux niveaux des ventes, des prix et de l’utilisation faite des produits médicamenteux brevetésNote de bas de page 1. La présente section donne les résultats statistiques clés de cette analyse.
Ventes et prix
La population canadienne consacre aujourd’hui une partie beaucoup plus grande de son budget à l’achat de produits médicamenteux brevetés qu’elle ne le faisait il y a une dizaine d’années; toutefois, il est important de préciser qu’une augmentation des dépenses en produits médicamenteux n’est pas nécessairement attribuable à une augmentation des prix. Par exemple, selon les rapports annuels du CEPMB des années 1995 à 2003, la valeur des ventes de produits médicamenteux brevetés a augmenté de plus de 10 % par année, alors que les taux moyens de variation des prix n’atteignaient même pas 1 %. Dans ces cas, ce sont le volume et la composition de l’utilisation faite des produits médicamenteux qui sont à l’origine de la croissance de la valeur des ventes.
Différents facteurs peuvent être à l’origine de tels changements, dont les suivants :
- augmentation de la population totale;
- variations de la composition démographique de la population (p. ex. vieillissement de la population et une plus grande incidence de problèmes de santé chez les personnes âgées);
- augmentation de l’incidence des problèmes de santé nécessitant une pharmacothérapie;
- nouvelles pratiques d’ordonnance des médecins (p. ex. tendance à prescrire des nouveaux produits médicamenteux plus onéreux pour traiter une condition qui était jusque-là traitée avec des produits existants souvent vendus à moindre prix, ou ordonnance de concentrations plus fortes ou plus fréquentes);
- recours plus régulier à des pharmacothérapies en remplacement d’autres formes de traitement;
- recours à de nouveaux produits médicamenteux pour traiter des conditions pour lesquelles il n’existait pas encore un traitement efficace;
- recours à de nouveaux produits médicamenteux lancés sur le marché à des prix plus élevés que les traitements antérieurs pour une maladie donnée.
Tendances observées au niveau des ventes
Le tableau 7 présente la valeur des ventes totales par les brevetés au Canada des produits médicamenteux brevetés pour les années 1990 à 2015. En 2015, les ventes de produits médicamenteux brevetés ont augmenté à 15,2 milliards de dollars par rapport à 13,8 milliards de dollars en 2014, ce qui représente une hausse de 9,5 %. Il s’agit du taux de croissance le plus élevé depuis 2003. En effet, il est deux fois plus important que tout taux de croissance annuel observé depuis 2003, et l’augmentation de 1,4 milliards de dollars par rapport à l’année précédente égale le record de l’augmentation la plus élevée des ventes de médicaments brevetés dans l’histoire du Canada.
La dernière colonne du tableau 7 présente la valeur des ventes des produits médicamenteux brevetés exprimée en pourcentage de la valeur des ventes de tous les produits médicamenteux. Entre 1990 et 2003, le pourcentage de la valeur des ventes est passé respectivement de 43,2 % à un sommet de 72,7 %. Ce pourcentage a reculé entre 2003 et 2009, mais est relativement stable depuis. Cela signifie que les ventes des produits médicamenteux de marque non brevetés et des produits médicamenteux génériques ont en général augmenté au même rythme dans les dernières années que celles de produits médicamenteux brevetés.
Facteurs à la source de la croissance des ventes
Le tableau 8 décompose en différents éléments la croissance des ventes enregistrée entre 2014 et 2015. Ces éléments sont les suivants :
- produits médicamenteux auparavant brevetés dont le brevet est arrivé à échéance ou qui ont quitté le marché canadien (« effet du retrait du médicament »);
- produits médicamenteux brevetés lancés sur le marché canadien en 2015 (« effet du nouveau médicament »);
- variations des prix des produits médicamenteux brevetés vendus au Canada en 2014 et en 2015 (« effet du prix »);
- écarts de quantités vendues de ces produits médicamenteux en 2014 et en 2015 (« effet du volume »);
- interactions des variations de prix et de quantité (« effet croisé »).
La première rangée du tableau 8 présente les incidences d’après leur valeur monétaire et la deuxième rangée les présente au moyen de la variation des ventes entre 2014 et 2015. Pour des fins de comparaison, la troisième rangée présente les incidences avec les taux moyens annuels de variation des ventes pour la période de 2011 à 2014.Note de bas de page 2
Les résultats de ce tableau révèlent que l’augmentation des ventes totales survenue entre 2014 et 2015 découlait de deux facteurs : augmentations de la quantité de produits médicamenteux vendus et ventes importantes de nouveaux produits médicamenteux, ce qui vient compenser un effet du retrait du médicament relativement important. Si on examine les valeurs ventilées pour 2015-2014 par rapport à 2014-2013, elles sont proportionnellement presque identiques.
Tableau 7. Ventes de produits médicamenteux brevetés, 1990-2015
| Année |
Produits médicamenteux brevetés
Ventes (en milliards de $) |
Produits médicamenteux brevetés
Variation (en %) |
Ventes de produits médicamenteux brevetés par rapport à la valeur des ventes de tous les médicaments (en %)* |
| 2015 |
15,2 |
9,5 |
61,8 |
| 2014 |
13,8 |
3,1 |
59,9 |
| 2013 |
13,4 |
4,2 |
60,7 |
| 2012 |
12,9 |
0,1 |
59,2 |
| 2011 |
12,9 |
3,5 |
58,3 |
| 2010 |
12,4 |
-4,3 |
55,8 |
| 2009 |
13,0 |
2,9 |
59,6 |
| 2008 |
12,6 |
4,6 |
61,7 |
| 2007 |
12,1 |
3,2 |
63.2 |
| 2006 |
11,7 |
7,4 |
67,8 |
| 2005 |
10,9 |
4,2 |
70,6 |
| 2004 |
10,5 |
7,8 |
72,2 |
| 2003 |
9,7 |
9,0 |
72,7 |
| 2002 |
8,9 |
17,5 |
67,4 |
| 2001 |
7,6 |
18,9 |
65,0 |
| 2000 |
6,3 |
16,7 |
63,0 |
| 1999 |
5,4 |
27,0 |
61,0 |
| 1998 |
4,3 |
18,9 |
55,1 |
| 1997 |
3,7 |
22,6 |
52,3 |
| 1996 |
3,0 |
12,8 |
45,0 |
| 1995 |
2,6 |
10,8 |
43,9 |
| 1994 |
2,4 |
-2,1 |
40,7 |
| 1993 |
2,4 |
9,4 |
44,4 |
| 1992 |
2,2 |
14,0 |
43,8 |
| 1991 |
2,0 |
13,1 |
43,2 |
| 1990 |
1,7 |
– |
43,2 |
* Le dénominateur dans ce ratio comprend la valeur des ventes des produits médicamenteux de marque brevetés, des produits médicamenteux de marque non brevetés et des produits médicamenteux génériques. L’estimation de la valeur totale des ventes utilisée pour calculer le ratio à compter de 2005 se fonde sur les données tirées de la base de données MIDASMC d’IMS AG. Pour les années antérieures, les données d’IMS n’ont été utilisées que pour calculer la valeur des ventes des produits médicamenteux génériques. Quant à la valeur des ventes des produits médicamenteux de marque non brevetés, elle était alors estimée à l’aide des données fournies par les brevetés. Pour mettre un terme aux anomalies attribuables aux variations annuelles de la liste des sociétés faisant rapport au CEPMB, le CEPMB n’utilise plus cette approche. Les ratios rapportés pour les années avant 2005 gonflaient probablement la part des produits médicamenteux brevetés, mais seulement dans une faible proportion. Ce léger écart n’invalide toutefois pas la forte tendance à la hausse observée pour les années 1990 à 2003. Les ratios depuis 2009 ont aussi été légèrement révisés suivant les mises à jour des données d’IMS Health. Aucun changement n’a entraîné un écart supérieur à 0,4 %.
Sources : CEPMB; Base de données MIDASMC, 2005-2015, IMS AG. Tous droits réservés.Note de bas de page 3
Tableau 8. Décomposition des variations au chapitre des ventes de produits médicamenteux brevetés
|
Variation totale |
Effet du retrait du médicament |
Effet du nouveau médicament |
Effet du prix |
Effet du volume |
Effet croisé |
Incidence sur les ventes, 2015/2014
(en M$) |
384,09 |
-344,48 |
354,39 |
1,93 |
386,53 |
-14,29 |
Proportion de la variation totale
2015/2014 (%)
|
100,00 |
-89,69 |
92,27 |
0,50 |
100,64 |
-3,72 |
Proportion moyenne de la variation totale,
2011-2014 (en %) |
100,00 |
-146,55 |
189,74 |
31,38 |
39,60 |
-14,16 |
Source : CEPMB
La figure 2 présente pour 2015 une ventilation des ventes de produits médicamenteux brevetés selon l’année de leur première vente au Canada. Au cours de la dernière partie des années 1990 et du début des années 2000, la croissance des ventes a été grandement associée à une succession de nouveaux médicaments « vedettes » qui ont donné lieu à des volumes de ventes très élevés. Malgré l’expiration récente des brevets (« chute des brevets »), ces produits représentent toujours un pourcentage considérable des ventes en 2015. Toutefois, c’est surtout la mise en marché de plusieurs traitements très efficaces contre l’hépatite C en 2014 qui a contribué de façon significative à l’augmentation de la part des ventes relative aux médicaments lancés cette année-là.
Figure 2. Pourcentage des ventes de produits médicamenteux brevetés selon l’année de lancement, 2015
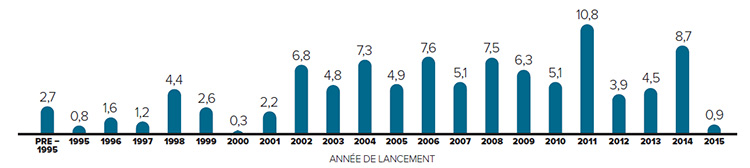
Description de la figure
Il s’agit d’un diagramme à barres présentant le pourcentage des ventes, en 2015, de produits médicamenteux brevetés en fonction de leur année de lancement au Canada. Les produits médicamenteux commercialisés avant 1995 représentaient 2,7 % des parts de marché en 2015. 1995 : 0,8; 1996 : 1,6; 1997 : 1,2; 1998 : 4,4; 1999 : 2,6; 2000 : 0,3; 2001 : 2,2; 2002 : 6,8; 2003 : 4,8; 2004 : 7,3; 2005 : 4,9; 2006 : 7,6; 2007 : 5,1; 2008 : 7,5; 2009 : 6,3; 2010 : 5,1; 2011 : 10,8; 2012 : 3,9; 2013 : 4,5; 2014 : 8,7; 2015 : 0,9.
Ventes selon le groupe thérapeutique
Pour ses analyses, le CEPMB classe généralement les produits médicamenteux à l’aide du Système de classification anatomique, thérapeutique, chimique (ATC) de l’Organisation mondiale de la Santé (OMS). Ce système scientifique hiérarchique classe les produits médicamenteux selon leur utilisation thérapeutique principale et leur composition chimique. Au premier niveau de ce système, à savoir au niveau 1, le système ATC classe les produits médicamenteux selon la partie de l’anatomie à laquelle ils sont principalement associés.
Le tableau 9 ventile les ventes des produits médicamenteux brevetés effectuées au Canada en 2015 selon le premier niveau de la classification ATC. Il présente les ventes effectuées en 2015 dans les différents groupes de produits médicamenteux, leur part de l’ensemble des ventes ainsi que le taux d’augmentation de la valeur de leurs ventes par rapport à 2014. Les valeurs présentées dans la dernière colonne correspondent à la composante de la croissance de l’ensemble des ventes attribuables aux produits médicamenteux du groupe correspondantNote de bas de page 4. La mesure ainsi obtenue permet de dégager que ce sont les antiinfectieux généraux pour usage systémique et les agents antinéoplasiques et immunomodulateurs qui ont le plus contribué à la croissance de la valeur des ventes. Le recul des ventes à la fois de médicaments agissant sur le système cardiovasculaire et de médicaments agissant sur le système nerveux ont aussi eu un impact important sur les dépenses globales.
Tableau 9. Ventes des produits médicamenteux brevetés selon leur groupe thérapeutique principal, 2015
| Groupe thérapeutique |
Ventes en 2015
(en M$) |
Part de ventes en 2015
(en %) |
Croissance : 2015/2014
(en M$) |
Croissance : 2015/2014
(en %) |
Incidence sur la variation des dépenses
(en %) |
| A : Tube digestif et métabolisme |
1 599,8 |
10,6 |
94,1 |
6,2 |
7,1 |
| B : Sang et organes sanguinoformateurs |
770,3 |
5,1 |
-17,8 |
-2,3 |
-1,4 |
| C : Système cardiovasculaire |
809,5 |
5,3 |
-104,2 |
-11,4 |
-7,9 |
| D : Produits dermatologiques |
100,4 |
0,7 |
-9,3 |
-8,5 |
-0,7 |
| G : Système génito-urinaire et hormones sexuelles |
536,2 |
3,5 |
23,0 |
4,5 |
1,7 |
| H : Préparations hormonales systémiques |
63,0 |
0,4 |
0,7 |
1,1 |
0,1 |
| J : Antiinfectieux généraux pour usage systémique |
2 396,1 |
15,8 |
797,2 |
49,9 |
60,4 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
4 723,3 |
31,2 |
489,0 |
11,5 |
37,0 |
| M : Système musculo-squelettaire |
361,7 |
2,4 |
-90,4 |
-20,0 |
-6,8 |
| N : Système nerveux |
1 621,0 |
10,7 |
-75,9 |
-4,5 |
-5,8 |
| R : Système respiratoire |
1 237,5 |
8,2 |
73,0 |
6,3 |
5,5 |
| S : Organes sensoriels |
791,6 |
5,2 |
69,7 |
9,6 |
5,3 |
| V : Divers |
151,8 |
1,0 |
71,3 |
88,5 |
5,4 |
| Tous les groupes thérapeutiques † |
15 162,2 |
100,0 |
1 320,3 |
9,5 |
100,0 |
† Il se peut que les valeurs de cette ligne ne totalisent pas en raison de l’arrondissement.
Source : CEPMB
Tendances observées au niveau des prix
Le CEPMB utilise l’indice des prix des médicaments brevetés (IPMB) pour faire le suivi des tendances des prix des produits médicamenteux brevetés. L’IPMB mesure la variation moyenne des prix auxquels les brevetés vendent leurs produits médicamenteux brevetés sur le marché canadien (prix départ usine) par rapport à l’année précédente. L’indice est calculé à l’aide de la formule qui correspond à la moyenne de la variation des prix au niveau du produit médicamenteux pondérée en fonction des ventesNote de bas de page 5. La méthodologie utilisée rappelle celle qu’utilise Statistique Canada pour compiler l’indice des prix à la consommation (IPC). L’IPMB est fondé sur l’information sur les prix moyens par transaction et sur les ventes pour une période de six mois, dont les brevetés font rapport au Conseil.
Il est important de bien comprendre la relation théorique qui existe entre l’IPMB et les coûts des produits médicamenteux. L’IPMB ne mesure pas les effets des changements de l’utilisation faite des produits médicamenteux brevetés. Cette mesure est prise par un autre indice appelé l’indice du volume des ventes de médicaments brevetés – l’IVVMB (voir la section « Utilisation faite des produits médicamenteux brevetés »). L’IPMB ne mesure pas non plus l’incidence sur les coûts des nouvelles habitudes d’ordonnance des médecins ou de l’arrivée sur le marché de nouveaux produits médicamenteux. L’IPMB est conçu pour isoler la composante de variation des ventes attribuable aux variations des prix.
La figure 3 présente le taux annuel de variation de l’IPMB pour les années 1988 à 2015. Selon la mesure prise par l’IPMB, les prix des produits médicamenteux brevetés n’ont pratiquement pas changé entre 2014 et 2015.
Figure 3. Taux annuel de variation (%) de l’indice des prix des médicaments brevetés (IPMB), 1988-2015
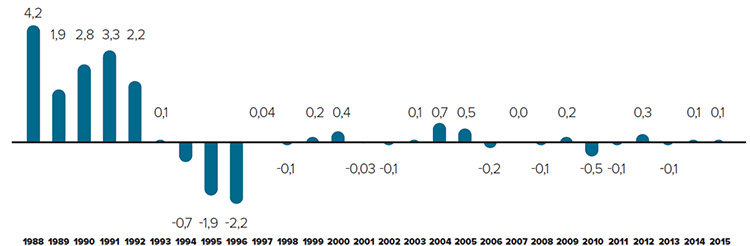
Description de la figure
Il s’agit d’un diagramme à barres présentant les taux annuels de variation, en pourcentage, de l’Indice des prix des médicaments brevetés (IPMB), de 1988 à 2015. En 1988, le taux de variation de l’IPMB était de 4,2 %. 1989 : 1,9; 1990 : 2,8; 1991 : 3,3; 1992 : 2,2; 1993 : 0,1; 1994 : -0,7; 1995 : -1,9; 1996 : -2,2; 1997 : 0,04; 1998 : -0,1; 1999 : 0,2; 2000 : 0,4; 2001 : -0,03; 2002 : -0,1; 2003 : 0,1; 2004 : 0,7; 2005 : 0,5; 2006 : -0,2; 2007 : 0,0; 2008 : -0,1; 2009 : 0,2; 2010 : -0,5; 2011 : -0,1; 2012 : 0,3; 2013 : -0,1; 2014 : 0,1; 2015 : 0,1.
La Loi sur les brevets prévoit que le CEPMB doit tenir compte des variations de l’IPC, entre autres facteurs, lorsqu’il est appelé à déterminer si le prix d’un médicament breveté est ou non excessif. La figure 4 présente les variations annuelles de l’IPMB par rapport aux variations de l’IPC pour les mêmes années. L’inflation générale des prix, mesurée au moyen de l’IPC, a été supérieure à l’augmentation moyenne des prix des produits médicamenteux brevetés presque chaque année depuis 1988. En 2015, l’IPC a augmenté de 1,1 %, alors que l’IPMB a augmenté de 0,1 % entre 2014 et 2015.
Figure 4. Taux annuel de variation de l’indice des prix des médicaments brevetés (IPMB) et de l’indice des prix à la consommation (IPC), 1988-2015
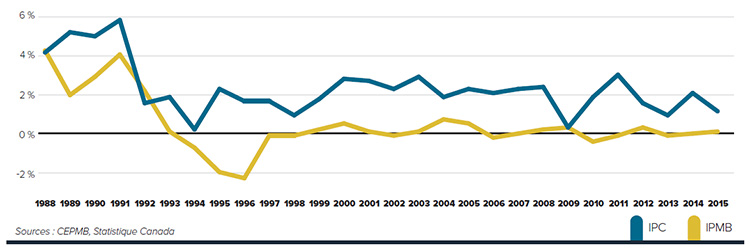
Description de la figure
Il s’agit d’un diagramme linéaire présentant, en pourcentage, le taux annuel de variation de l’Indice des prix des médicaments brevetés (IPMB) par rapport aux variations correspondantes de l’Indice des prix à la consommation (IPC). En 1988, le taux de variation de l’IPMB était de 0,041 %. Le taux de variation de l’IPC était de 0,04 % pour la même année. 1989 : IPMB 0,019, IPC 0,05; 1990 :IPMB 0,028, IPC 0,048; 1991 : IPMB 0,039, IPC 0,056; 1992 : IPMB 0,021, IPC 0,015; 1993 : IPMB 0,001, IPC 0,018; 1994 : IPMB -0,007, IPC 0,002; 1995 : IPMB -0,019, IPC 0,022; 1996 : IPMB -0,022, IPC 0,016; 1997 : IPMB -0,001, IPC 0,016; 1998 : IPMB -0,001, IPC 0,009; 1999 : IPMB 0,002, IPC 0,017; 2000 : IPMB 0,005, IPC 0,027; 2001 : IPMB 0,001, IPC, 0,026; 2002 : IPMB -0,001, IPC 0,022; 2003 : IPMB 0,001, IPC 0,028; 2004 : IPMB 0,007, IPC 0,018; 2005 : IPMB 0,005, IPC 0,022; 2006 : IPMB -0,002, IPC 0,020; 2007 : IPMB 0,000, IPC 0,022; 2008 : IPMB 0,002, IPC 0,023; 2009 : IPMB 0,003, IPC 0,003; 2010 : IPMB -0,004, IPC 0,018; 2011 : IPMB -0,001, IPC 0,029; 2012 : IPMB 0,003, IPC 0,015; 2013 : IPMB -0,001, IPC 0,009; 2014 : IPMB 0,001, IPC 0,020; 2015 : IPMB 0,001, IPC 0,011.
Il n’est pas surprenant que l’IPMB ait rarement augmenté au même rythme que l’IPC. Les Lignes directrices du CEPMB prévoient en effet que les prix des produits médicamenteux brevetés ne peuvent augmenter davantage que le taux moyen d’augmentation de l’IPC calculé sur une période de trois ans. (Les Lignes directrices limitent également les augmentations annuelles de prix à une fois et demie le taux d’inflation calculé à l’aide de l’IPC.) Cette exigence a pour effet de limiter les augmentations des prix des produits à celles de l’IPC sur une période de trois annéesNote de bas de page 6. En pratique, les variations de l’IPC n’atteignent jamais cette limite étant donné qu’un grand nombre de brevetés n’augmentent pas les prix de leurs médicaments dans toute la mesure autorisée par les Lignes directrices.
Variation du prix selon le groupe thérapeutique
Le tableau 10 présente les taux moyens de variation des prix des produits médicamenteux brevetés au niveau de leur groupe thérapeutique principal. Ce tableau a été établi en appliquant la méthode de calcul de l’IPMB aux données sur les prix des différents produits médicamenteux brevetés ventilées selon le niveau 1 de la classification ATC. La dernière colonne du tableau présente le résultat de la décomposition de la variation globale de l’IPMB où chaque entrée représente la composante attribuable aux produits médicamenteux du groupe thérapeutique correspondant. Selon cette mesure, l’IPMB (0,7 %) indique que les prix des produits médicamenteux des différents groupes thérapeutiques sont relativement stables. Veuillez noter que tous les groupes thérapeutiques ont affiché, en moyenne, un taux de variation des prix inférieur au taux d’inflation de l’IPCNote de bas de page 7.
Tableau 10. Variation de l’indice des prix des médicaments brevetés (IPMB) selon le groupe thérapeutique principal, 2015
| Groupe thérapeutique |
Pourcentage des ventes
en 2015
(en %) |
Variation des prix
de 2014 à 2015
(en %) |
Contribution :
Variation de l'IPMB
(en %) |
| A : Tube digestif et métabolisme |
10,6 |
0,00 |
0,00 |
| B : Sang et organes sanguinoformateurs |
5,1 |
0,72 |
0,04 |
| C : Système cardiovasculaire |
5,3 |
0,16 |
0,01 |
| D : Produits dermatologiques |
0,7 |
0,27 |
0,00 |
| G : Système génito-urinaire et hormones sexuelles |
3,5 |
-0,20 |
-0,01 |
| H : Préparations hormonales systémiques |
0,4 |
0,22 |
0,00 |
| J : Antiinfectieux généraux pour usage systémique |
15,8 |
0,70 |
0,11 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
31,2 |
-0,35 |
-0,11 |
| M : Système musculo-squelettaire |
2,4 |
-0,43 |
-0,01 |
| N : Système nerveux |
10,7 |
0,34 |
0,04 |
| R : Système respiratoire |
8,2 |
0,12 |
0,01 |
| S : Organes sensoriels |
5,2 |
0,23 |
0,01 |
| V : Divers |
1,0 |
-1,59 |
-0,02 |
| Tous les groupes thérapeutiques |
100,0† |
0,07 |
0,07 |
† Il se peut que les valeurs de cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Variation des prix selon la catégorie de clients
La figure 5 présente les taux moyens de variation des prix selon la catégorie de clientsNote de bas de page 8. Ces taux ont été obtenus en appliquant séparément la méthodologie de l’IPMB aux données sur les ventes faites aux hôpitaux, aux pharmacies et aux grossistesNote de bas de page 9. Pour 2015, les taux de variation des prix étaient de 0,0 %, de 1,1 % et de -0,2 % respectivement.
Figure 5. Taux annuel de variation (%) de l’indice des prix des médicaments brevetés (IPMB) selon la catégorie de clients, 2012-2015
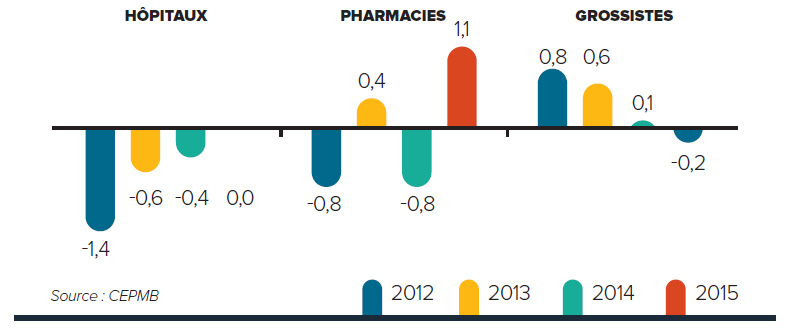
Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, le taux moyen de variation des prix par catégorie de clients. En 2012, le taux moyen de variation de prix était de -1,4 % pour la catégorie hôpital, de - 0,8% pour la catégorie pharmacie et de 0,8 % pour la catégorie grossiste.
2013 : hôpital -0.6, pharmacie 0.4, grossiste 0,6;
2014 : hôpital -0.4, pharmacie -0.8, grossiste 0.1;
2015 : hôpital 0,0, pharmacie 1.1, grossiste -0,2.
Variation des prix selon la province ou le territoire
La figure 6 présente les taux moyens annuels de variation des prix selon la province ou le territoire. Ces taux ont été obtenus en appliquant la méthodologie du calcul de l’IPMB aux données sur les ventes ventilées selon la province ou le territoire dans lequel les ventes ont été effectuées. Ces résultats révèlent que, entre 2014 et 2015, les prix de transaction moyens des produits médicamenteux brevetés ont baissé au Québec pour toutes les catégories de clients.
Figure 6. Taux annuel de variation des prix, par province ou territoire*, par catégorie de clients, 2015
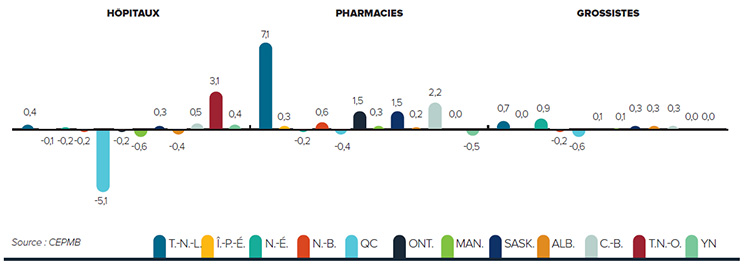
* Les valeurs pour le Nunavut sont comprises dans celles des Territoires du Nord-Ouest (T.N.-O.).
Source : CEPMB
Description de la figure
Il s’agit d’un diagramme à barres présentant le taux annuel moyen de variation des prix, par province ou territoire et par catégorie de clients entre 2014 et 2015.
Pour la catégorie hôpital:
- Terre-Neuve-et-Labrador, 0,4
- Île-du-Prince-Édouard, -0,1
- Nouvelle-Écosse, -0,2
- Nouveau Brunswick, -0,2
- Québec, -5,1
- Ontario, -0,2
- Manitoba, -0,6
- Saskatchewan, 0,3
- Alberta, -0,4
- Colombie-Britannique, 0,5
- Territoires du Nord-Quest, 3,1
- Yukon, 0,4
Pour la catégorie pharmacie:
- Terre-Neuve-et-Labrador, 7,1
- Île-du-Prince-Édouard, 0,3
- Nouvelle-Écosse, -0,2
- Nouveau Brunswick, 0,6
- Québec, -0,4
- Ontario, 1,5
- Manitoba, 0,3
- Saskatchewan, 1,5
- Alberta, 0,2
- Colombie-Britannique, 2,2
- Territoires du Nord-Quest, 0,0
- Yukon, -0,5
Pour la catégorie grossiste:
- Terre-Neuve-et-Labrador, 0,7
- Île-du-Prince-Édouard, 0,0
- Nouvelle-Écosse, 0,9
- Nouveau Brunswick, -0,2
- Québec, -0,6
- Ontario, 0,1
- Manitoba, 0,1
- Saskatchewan, 0,3
- Alberta, 0,3
- Colombie-Britannique, 0,3
- Territoires du Nord-Quest, 0,0
- Yukon, 0,0.
Variation du prix d’un produit médicamenteux breveté dans les années qui suivent son lancement sur le marché canadien
Le prix du produit médicamenteux breveté type varie-t-il beaucoup au cours des années qui suivent son lancement sur le marché canadien? La figure 7 répond à cette question en présentant le ratio moyen des prix de vente des produits médicamenteux en 2015 par rapport aux prix auxquels ils ont été offerts au moment de leur lancement sur le marché canadien.
Figure 7. Ratio moyen du prix de 2015 par rapport au prix de lancement, par année de lancement
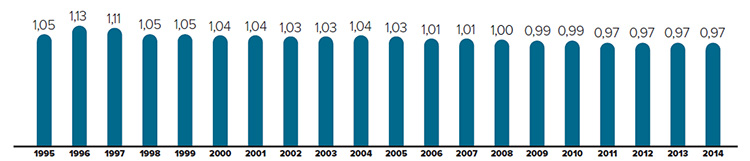
Description de la figure
Il s’agit d’un diagramme à barres présentant le ratio moyen du prix de 2015 par rapport au prix de lancement d’un médicament breveté type (prix de vente du médicament au cours de son année de lancement sur le marché canadien).
Pour 1995, le ratio moyen entre le prix de vente de 2015 et le prix de lancement est de 1,05. 1996, 1,13; 1997, 1,11; 1998, 1,05; 1999, 1,05; 2000, 1,04; 2001, 1,04; 2002, 1,03; 2003, 1,03; 2004, 1,04; 2005, 1,03; 2006, 1,01; 2007, 1,01; 2008, 1,00; 2009, 0,99; 2010, 0,99; 2011, 0,97; 2012, 0,97; 2013, 0,97; 2014, 0,97.
Les résultats présentés à la figure 7 indiquent une tendance uniforme selon laquelle les prix demeurent stables tôt dans le cycle de vie, puis augmentent graduellement au cours des années subséquentes. Cela s’harmonise avec l’effet de la méthodologie de l’IPC du CEPMBNote de bas de page 10. Par exemple, les prix des produits lancés il y a une décennie sont seulement 3 % plus élevés en 2015.
Variation des prix selon le pays
La Loi et son Règlement obligent les brevetés à faire rapport des prix de leurs produits médicamenteux brevetés accessibles au public qu’ils pratiquent dans les sept pays de comparaison nommés dans le Règlement (« CEPMB7 »). Ces pays sont la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis.
Le CEPMB utilise ces données aux fins suivantes :
- pour effectuer ses comparaisons des prix internationaux prévues dans les Lignes directrices;
- pour comparer les prix des produits médicamenteux brevetés pratiqués au Canada avec les prix pratiqués dans d’autres pays.
La figure 8 présente les taux moyens annuels de variation des prix pour le Canada et pour les sept pays de comparaison. Ces valeurs ont été obtenues en appliquant la méthodologie de l’IPMB (avec pondération pour tenir compte des tendances des ventes au Canada) aux données sur les prix pratiqués dans les différents pays de comparaison soumises par les brevetés au CEPMB. À titre d’information, les résultats pour les États-Unis sont fondés sur des prix qui tiennent compte des prix de la Classification fédérale des approvisionnements (US Federal Supply Schedule ou FSS)Note de bas de page 11.
Figure 8. Taux moyens annuels de variation des prix pratiqués au Canada et dans les pays de comparaison, 2015

Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, les taux moyens annuels de variation des prix au Canada et dans chacun des sept pays de comparaison. Au Canada, le taux moyen annuel de variation des prix était de 0,1. France, -3,8; Italie, -2,1; Allemagne, -0,6; Suède, -3,9; Suisse, -2,9; Royaume-Uni, 0,2; États-Unis, 9,1.
Les résultats présentés à la figure 8 indiquent que, en 2015, les prix aux États-Unis ont augmenté, en moyenne, de 9,1 %. Les prix au Royaume-Uni sont demeurés stables, alors que les prix en France, en Italie, en Suisse, en Suède et en Allemagne ont diminué. Ces résultats concordant avec la tendance observée à long terme selon laquelle les prix des médicaments brevetés baissent graduellement au fil du temps dans la plupart des pays de comparaison (sauf les États-Unis), alors qu’ils augmentent lentement au Canada.
Les résultats s’appliquant au marché étranger se basent sur des données relatives au prix départ usine accessibles au public (habituellement dans la catégorie des clients de la vente au détail) qui sont soumises par les brevetés au CEPMB. Toutefois, pour le Canada, le taux de variation se fonde sur les prix moyens réels par transaction et ne tient pas compte des remises et des rabais accordés par les fabricants directement à leurs clients.
Comparaison des prix pratiqués au Canada avec ceux pratiqués à l’étranger
Les tableaux 11 et 12 présentent des statistiques détaillées qui permettent de comparer les prix des produits médicamenteux brevetés pratiqués à l’étranger avec ceux pratiqués au Canada. Chaque tableau présente deux séries de ratios de prix moyens. Les tableaux sont différents l’un de l’autre selon la méthode de conversion en équivalents dollars canadiens des prix exprimés dans la devise des différents pays. Les deux tableaux présentent également le nombre de produits médicamenteux (DIN) et le volume des ventes couverts par chaque ratio de prixNote de bas de page 12.
Les ratios de prix moyens donnés dans les tableaux 11 et 12 sont des moyennes arithmétiques pondérées de ratios de prix obtenues pour des produits médicamenteux individuels, dont la pondération est fondée sur les tendances des ventes au Canada. Les ratios moyens de prix interprétés de cette façon donnent des réponses exactes aux questions comme celle-ci :
« Combien les Canadiens auraient-ils payé, en plus ou en moins, leurs produits médicamenteux brevetés en 2015 s’ils les avaient achetés aux prix pratiqués dans le pays X? »
Par exemple, on peut voir dans le tableau 11 que le ratio du prix moyen en France par rapport au prix moyen au Canada calculé avec la moyenne arithmétique est de 0,75 pour 2015. Ce ratio signifie que les Canadiens auraient payé leurs médicaments brevetés 25 % de moins en 2015 s’ils avaient pu les acheter aux prix pratiqués en France.
Pendant bon nombre d’années, le CEPMB a fait rapport des ratios des prix moyens pratiqués dans les pays de comparaison par rapport aux prix moyens pratiqués au Canada après avoir converti les prix pratiqués dans les pays de comparaison en équivalents dollars canadiens à l’aide des moyennes des taux de change (ou, plus précisément, les moyennes mobiles des taux de change sur une période de 36 mois que le CEPMB utilise généralement lorsqu’il applique ses Lignes directrices). Le tableau 11 compare également les ratios des prix dans les pays de comparaison par rapport à leurs prix au Canada, après avoir converti la devise à l’aide de la parité des pouvoirs d’achat. Le taux de parité des pouvoirs d’achat représente le coût de la vie relatif dans ces deux pays exprimé dans leurs devises respectives. En pratique, le coût de la vie est calculé à l’aide d’un « panier » de produits et de services aux prix courants dans chaque pays.
Étant donné que les taux de parité des pouvoirs d’achat représentent le coût relatif de la vie dans chacun des pays, ils constituent un moyen simple de rajuster les prix pour tenir compte des différences de prix, de revenus et d’autres valeurs monétaires dans la comparaison des prix pratiqués dans les différents pays. Appliqués au calcul des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, les taux de parité des pouvoirs d’achat fournissent des statistiques qui nous permettent de répondre à des questions comme celle-ci :
« Dans quelle mesure les Canadiens auraient-ils dû sabrer dans leur consommation de biens et de services pour acheter des produits médicamenteux brevetés si, en 2015, ils avaient vécu dans le pays X? »
On ne peut répondre à une telle question en limitant la comparaison aux prix des produits médicamenteux. Il faut plutôt calculer ce que chaque prix représente en termes de biens et de services sacrifiés. C’est précisément ce que permettent de faire les parités des pouvoirs d’achat.
Comparaisons bilatérales des prix
Le tableau 11 compare les prix pratiqués dans les sept pays de comparaison avec ceux pratiqués au Canada. D’après les résultats de la conversion des différentes devises aux taux de change du marché, il semble que, comme dans les années antérieures, les prix pratiqués au Canada se situaient en général dans la gamme des prix observés parmi les pays de comparaison. Les prix en France, en Italie, au Royaume-Uni et en Suède étaient beaucoup moins élevés qu’au Canada, alors que ceux en Allemagne étaient plus élevés. Comme dans les années antérieures, les prix déclarés étaient beaucoup plus élevés aux États-Unis qu’au Canada et que dans tous les autres pays de comparaison. Les prix en Suisse étaient comparables aux prix au Canada en 2015.
Tableau 11. Ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, comparaisons bilatérales, 2015
Taux de change du marché
|
Canada |
France |
Italie |
Allemagne |
Suède |
Suisse |
Royaume-Uni |
États-Unis |
| Ratio moyen des prix en 2015 |
1,00 |
0,75 |
0,87 |
1,16 |
0,94 |
1,00 |
0,92 |
2,70 |
| Ratio moyen des prix en 2014 |
1,00 |
0,75 |
0,87 |
1,14 |
0,96 |
0,97 |
0,86 |
2,47 |
Parités des pouvoirs d’achat
|
Canada |
France |
Italie |
Allemagne |
Suède |
Suisse |
Royaume-Uni |
États-Unis |
| Ratio moyen des prix en 2015 |
1,00 |
0,80 |
0,97 |
1,27 |
0,81 |
0,79 |
0,92 |
2,95 |
| Ratio moyen des prix en 2014 |
1,00 |
0,82 |
1,05 |
1,32 |
0,88 |
0,80 |
0,93 |
2,97 |
| Nombre de produits médicamenteux brevetés en 2015 |
1 358 |
768 |
859 |
987 |
913 |
893 |
957 |
1 118 |
| Ventes (en M$)Note de bas de page 13 |
15 038,63 |
9 868,98 |
11 424,13 |
13 090,13 |
12 558,45 |
12 594,87 |
12 752,60 |
13 945,83 |
Source : CEPMB
Il importe de prendre note qu’il n’est pas toujours possible de trouver un prix correspondant dans chaque pays de comparaison pour chacun des produits médicamenteux brevetés vendus au Canada. Le tableau 11 illustre la fréquence de disponibilité d’un prix de comparaison pratiqué dans chacun des pays de comparaison. Par exemple, parmi les 1 359 produits médicamenteux brevetés assujettis à la compétence du CEPMB en 2015, un prix départ usine publiquement disponible n’était disponible pour la France que dans 57 % des cas, alors que le même chiffre pour les États-Unis s’élevait à 82 %. Vu le caractère intégré de la chaîne d’approvisionnement du Canada et des États-Unis, il arrive souvent que les États-Unis constituent le seul autre pays pour lequel un prix de comparaison est disponible relativement à un produit vendu au Canada. Dans un tel cas, ce prix est considéré comme étant le prix international médian aux fins de la méthodologie du CEPMB.
Les ratios moyens de prix obtenus à la suite de la conversion des devises aux taux de parité des pouvoirs d’achat permettent de tirer les mêmes conclusions. Si l’on tient compte des différences du coût de la vie dans les pays de comparaison, le Canada se présente comme le pays où les coûts de consommation pour les produits médicamenteux brevetés étaient les plus élevés en 2015. En effet, ces coûts donnent à penser que les Canadiens ont dépensé davantage que les consommateurs des pays de comparaison, à l’exception des consommateurs de l’Allemagne et des États-Unis.
La figure 9 présente ces résultats dans une perspective historique. En 2005, les prix au Canada étaient généralement égaux ou inférieurs aux prix correspondants pratiqués dans tous les pays de comparaison, sauf en Italie. En 2015, les prix au Canada étaient résolument plus élevés que ceux pratiqués au Royaume-Uni, en France, en Italie et en Suède et comparables à ceux de la Suisse.
Figure 9. Ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada : 2005, 2015
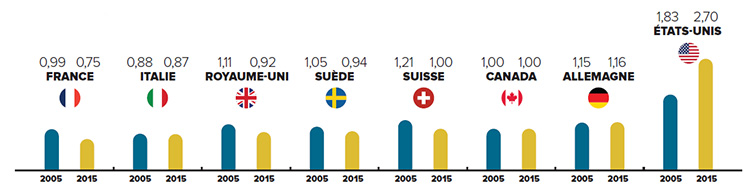
Description de la figure
Il s’agit d’un diagramme à barres présentant les ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada en 2005 et en 2015.
- France — 2005 : 0,99, 2015 : 0,75
- Italie — 2005 : 0,88, 2015 : 0,87
- Royaume-Uni — 2005 : 1,11, 2015 : 0,92
- Suède — 2005 : 1,05, 2015 : 0,94
- Suisse — 2005 : 1,21, 2015 : 1,00
- Canada — 2005 : 1,00, 2015 : 1,00
- Allemagne — 2005 : 1,15, 2015 : 1,16
- États-Unis — 2005 : 1,83, 2015 : 2,70
Si le médicament breveté est vendu dans un ou plusieurs des pays de comparaison (CEPMB7), le breveté doit soumettre les prix départ usine accessibles au public au CEPMB pour chaque catégorie de clientsNote de bas de page 14. Pour pouvoir évaluer comment se situe le Canada par rapport à un ensemble de pays plus large que le CEPMB7, la figure 10 utilise les prix pratiqués au Canada et à l’étranger consignés dans la base de données MIDASMC d’IMS AG au niveau du prix du fabricant départ usine de manière à tenir compte de toutes les ventes dans les secteurs des pharmacies et des hôpitaux.
Les comparaisons de prix étrangers consignées à la figure 10 permettent de faire une comparaison bilatérale des prix en se servant de tous les pays de l’Organisation de coopération et de développement économiques (OCDE) qui se trouvent dans la base de données MIDASMC d’IMS AG. Les ratios moyens du prix international par rapport aux prix canadiens sont calculés en se servant exactement de la même approche que celle utilisée pour produire les ratios présentés à la figure 9. Il s’agit de moyennes arithmétiques, pondérées en fonction des ventes canadiennes, pour les ratios du prix international correspondant par rapport au prix canadien pour des médicaments pris individuellementNote de bas de page 15. Comme il est indiqué ci-dessous, les prix médians de l’OCDE sont en moyenne 22 % sous les prix du Canada, qui se situent au troisième rang parmi les 31 pays de comparaison. Plus particulièrement, les trois pays où les prix sont les plus élevés sont maintenant les États-Unis et les deux pays avec lesquels ils sont les plus économiquement intégrés, soit le Mexique et le Canada).
Figure 10. Ratios moyens des prix étrangers par rapport aux prix canadiens, médicaments brevetés, OCDE, 2015
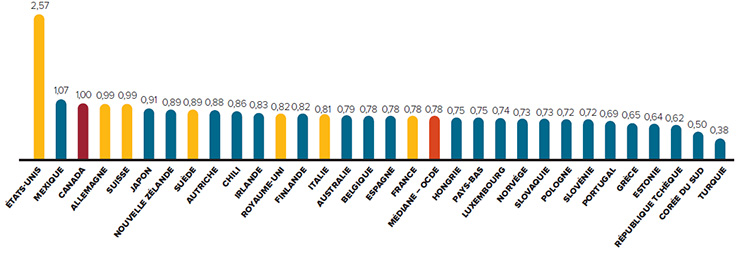
Source : Base de données MIDASMC, 2005-2015, IMS AG. Tous droits réservés.
Description de la figure
Il s’agit d’un diagramme à barres présentant le ratio moyen du prix des produits médicamenteux brevetés dans les pays de l’OCDE par rapport au prix du Canada en 2015. La comparaison a été réalisée au moyen du prix canadien et du prix international au départ de l’usine figurant dans la base de données MIDASMC d’IMS AG. États-Unis : 2,57; Mexique : 1,07; Canada : 1,00; Allemagne : 0,99; Suisse : 0,99; Japon : 0,91; Nouvelle-Zélande : 0,89; Suède : 0,89; Autriche : 0,88; Chili : 0,86; Irlande : 0,83; Royaume-Uni : 0,82; Finlande : 0,82; Italie : 0,81; Australie : 0,79; Belgique : 0,78; Espagne : 0,78; France : 0,78; OCDE : 0,78; Hongrie : 0,75; Pays-Bas : 0,75; Luxembourg : 0,74; Norvège : 0,73; Slovaquie : 0,73; Pologne : 0,72; Slovénie : 0,72; Portugal : 0,69; Grèce : 0,65; Estonie : 0,64; République tchèque : 0,62; Corée du Sud : 0,50; Turquie : 0,38.
Comparaisons multilatérales des prix
Le tableau 12 présente les ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, et ce, pour plusieurs mesures multilatérales des prix pratiqués dans les pays de comparaison. Le « prix international médian » correspond à la médiane des prix observés dans les sept pays de comparaison. D’autres ratios de prix multilatéraux comparent la moyenne minimale, maximale et simple des prix pratiqués dans les pays de comparaison par rapport aux prix au Canada.
Tableau 12. Ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, comparaisons multilatérales, 2015
|
Médiane |
Minimum |
Maximum |
Moyenne |
| Ratio moyen des prix aux taux de change du marché |
1,18 |
0,92 |
2,68 |
1,38 |
| Ratio moyen des prix aux parités de pouvoir d’achat |
1,17 |
0,91 |
2,92 |
1,43 |
| Nombre de produits médicamenteux brevetés |
1 274 |
1 274 |
1 274 |
1 274 |
| Ventes (en millions de $) |
14 658,19 |
14 658,19 |
14 658,19 |
14 658,19 |
Source : CEPMB
Une fois de plus sous l’angle des résultats obtenus avec les taux de change du marché, le ratio du prix international médian par rapport aux prix pratiqués au Canada s’est maintenu à 1,18 en 2015 (la valeur correspondante pour 2014 était de 1,13). Il convient de noter que la moyenne des prix pratiqués dans les pays de comparaison semble produire des ratios des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada plus élevés que les prix internationaux médians. Cette situation s’explique par l’influence des prix pratiqués aux États-Unis où les prix sont habituellement beaucoup plus élevés que dans tous les autres pays. Même si les prix pratiqués aux États-Unis sont presque toujours pris en compte dans la détermination du prix moyen pratiqué dans les pays de comparaison, ce n’est pas toujours le cas en ce qui concerne les prix internationaux médians. Néanmoins, les États-Unis exercent une influence notable sur le ratio moyen des prix internationaux médians par rapport aux prix pratiqués au Canada en raison du phénomène récurrent mentionné à la section précédente, où les États-Unis constituent le seul pays pour lequel un prix départ usine est disponible relativement à un produit médicamenteux breveté vendu au Canada.
La figure 11 replace ces résultats dans leur contexte historique en présentant l’historique des ratios moyens des prix internationaux médians par rapport aux prix pratiqués au Canada de 2001 à 2015. Même si le ratio a beaucoup changé au cours de cette période, il est demeuré au-dessus de la parité.
Figure 11. Ratio moyen du prix médian à l’étranger par rapport au prix médian au Canada aux taux de change du marché, 2001-2015
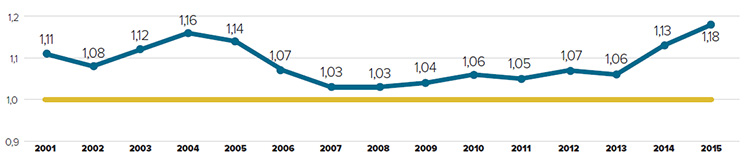
Description de la figure
Il s’agit d’un diagramme linéaire présentant l’historique des ratios moyens du prix international médian par rapport aux prix pratiqués au Canada de 2001 à 2015. En 2001, le ratio moyen du prix international médian (PIM) par rapport au prix de transaction moyen au Canada, aux taux de change du marché, était de 1,11. 2002 : 1,08; 2003 : 1,12; 2004 : 1,16; 2005 : 1,14; 2006 : 1,07; 2007 : 1,03; 2008 : 1,03; 2009 : 1,04; 2010 : 1,06; 2011 : 1,05; 2012 : 1,07; 2013 : 1,06; 2014 : 1,13; 2015 : 1,18.
La figure 12 présente d’autres résultats concernant le ratio moyen du prix international médian par rapport aux prix canadiens aux taux de change du marché en 2015. Afin de se pencher sur la question soulevée précédemment selon laquelle les prix canadiens sont des prix de vente moyens nationaux tandis que les prix étrangers sont des prix courants, on calcule un ratio prix courant-prix courant. Suivant cette méthode, le ratio moyen diminue de 1,18 à 1,08. Il importe de garder à l’esprit que les remises opaques accordées aux payeurs ne sont présentement pas consignées dans les données.
Afin de tenir compte de la grande incidence des prix américains au niveau de l’établissement du prix étranger médian, on fournit aussi à la figure 12 un ratio qui exclut les États-Unis et un ratio qui inclut au moins cinq pays dans le calcul de la valeur médiane. En tenant compte de ces restrictions, le ratio moyen du prix international médian par rapport aux prix canadiens diminue à 0,88 et à 0,90, respectivement, ce qui donne à penser que les prix courants canadiens sont en moyenne de 11 % à 13 % supérieurs aux prix courants étrangers médians. Dans bon nombre des pays de comparaison, des rabais sur les prix courants sont offerts à tous les payeurs publics et privés. En revanche, une grande proportion du marché canadien (jusqu’à 60 %) paie en fait le prix courant ou un prix approximatif. De plus, il convient de noter qu’il s’agit de ratios moyens – certains brevetés imposent aux consommateurs canadiens un prix moins élevé que les prix internationaux médians, alors que d’autres imposent des prix plus élevés. Pour voir les ratios médians par rapport aux prix canadiens par breveté, consultez le tableau 23 à l’annexe 3 du présent rapport.
Figure 12. Ratio moyen du prix international médian par rapport au prix canadien, aux taux de change du marché, 2015
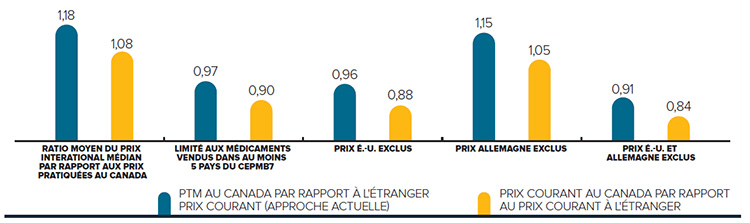
Description de la figure
Il s’agit d’un diagramme à barres présentant le ratio moyen du prix international médian (PIM) par rapport au prix pratiqué au Canada, aux taux de change du marché, selon les données de 2015.
|
Canada du PTM-N |
Canada au prix courant |
| Prix international médian pour CEPMB7 |
1,18 |
1,08 |
| Prix médian limité aux médicaments vendus dans au moins 5 pays du CEPMB7 |
0,97 |
0,90 |
| États-Unis exclus |
0,96 |
0,88 |
| Allemagne exclus |
1,15 |
1,05 |
| Allemagne et États-Unis exclus |
0,91 |
0,84 |
La figure 13 présente avec encore plus de détails les ratios des prix internationaux médians par rapport aux prix pratiqués au Canada au niveau des produits, ventilés selon les moyennes présentées dans le tableau 12. Cette figure ventile les ventes de chaque médicament breveté effectuées en 2015 selon le ratio des prix internationaux médians par rapport aux prix canadiens (ou, pour être plus précis, selon la fourchette dans laquelle s’inscrit le ratio)Note de bas de page 16. Ces résultats révèlent une dispersion importante des ratios de prix au niveau du produit. Alors que les produits dont les ratios du prix international médian par rapport au prix au Canada se situent entre 0,90 et 1,10 accaparaient 28,4 % des ventes, ceux dont les ratios se situent sous 0,90 en accaparaient 39,4 % et ceux dont les ratios dépassaient 1,10 en accaparaient 32,2 %.
En 2015, plus de 50 % des médicaments brevetés au Canada affichaient un prix supérieur aux niveaux médians internationauxNote de bas de page 17. Le tableau 13 illustre les catégories thérapeutiques dont les prix sont supérieurs aux niveaux médians internationaux au Canada. Les médicaments qui s’inscrivent dans le quatrième niveau ATC (« ATC4 ») Note de bas de page 18 sont regroupés afin de dresser la liste des sous-groupes distincts chimiques, pharmacologiques et thérapeutiques et de permettre le calcul des ratios moyens du prix international médian par rapport au prix canadien pour les médicaments qui peuvent être utilisés pour traiter les mêmes affections. Le tableau 13 présente les 10 principaux ATC4 de 2015 pour lesquels l’écart entre les prix canadiens et les prix médians a eu la plus grande incidence sur les dépenses en médicaments brevetés au Canada. Par exemple, si les prix canadiens avaient été semblables aux prix médians internationaux pour ces catégories de médicaments en 2015, les ventes au Canada auraient diminué de 850 millions de dollars (une diminution moyenne de 20 % pour ces ATC4). Sur les 95 DIN se classant dans ces 10 ATC4, le prix de plus de 60 % d’entre eux était plus élevé que le prix médian international.
Figure 13. Distribution d’intervalle des ventes, selon le ratio du prix international médian par rapport aux prix canadiens, 2015
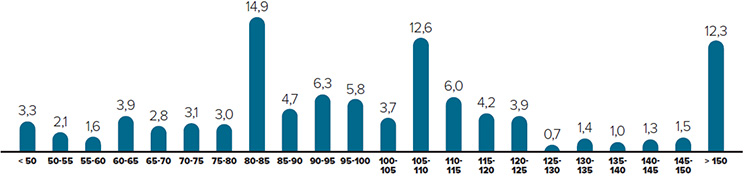
Description de la figure
Il s’agit d’un diagramme à barres présentant la distribution d’intervalle des ventes en 2015 pour chaque produit médicamenteux breveté, selon le ratio du prix international médian par rapport aux prix canadiens (plus exactement, selon l’intervalle dans lequel se trouve le ratio).
‹ 0,50 : 3,3; 0,50 à 0,55 : 2,1; 0,55 à 0,60 : 1,6; 0,60 à 0,65 : 3,9; 0,65 à 0,70 : 2,8; 0,70 à 0,75 : 3,1; 0,75 à 0,80 : 3,0; 0,80 à 0,85 : 14,9; 0,85 à 0,90 : 4,7; 0,90 à 0,95 : 6,3; 0,95 à 1,00 : 5,8; 1,00 à 1,05 : 3,7; 1,05 à 1,10 : 12,6; 1,10 à 1,15 : 6,0; 1,15 à 1,20 : 4,2; 1,20 à 1,25 : 3,9; 1,25 à 1,30 : 0,7; 1,30 à 1,35 : 1,4; 1,35 à 1,40 : 1,0; 1,40 à 1,45 : 1,3; 1,45 à 1,50 : 1,5; › 1,50 : 12,3.
Tableau 13. Dix principaux ATC4 par revenu total supérieur aux prix médians internationaux, 2015
| Description |
ATC4 |
Nbre total de produits chimiques dans la catégorie ATC4 (nbre breveté)Note de bas de page 19 |
Nbre d’entreprises |
Total de DIN brevetés |
DIN brevetés supérieurs au prix médian |
Revenu net en 2015 pour les DIN brevetés |
Part des revenus de 2015 attribuable aux DIN brevetés de la catégorie ATC4 |
Ratio des PMI par rapport au prix canadien (min. 5 pays) des DIN brevetés |
Répercussion financière de l’écart sur les médicaments brevetés en 2015 |
| Adrénergiques en association avec des corticostéroïdes ou autres médicaments, sauf les anticholinergiques |
R03AK |
5 (4) |
3 |
11 |
7 |
548 358 624 $ |
3,9 % |
65 % |
173 674 570 $ |
| Autres antidépresseurs |
N06AX |
6 (3) |
6 |
5 |
3 |
314 255 201 $ |
2,2 % |
50 % |
125 359 850 $ |
| Inhibiteurs du facteur de nécrose tumorale alpha |
L04AB |
4 (3) |
3 |
7 |
1 |
957 621 400 $ |
6,8 % |
88 % |
119 364 435 $ |
| Agents antinéovascularisation |
S01LA |
2 (2) |
2 |
3 |
3 |
590 343 927 $ |
4,2 % |
84 % |
84 011 452 $ |
| Inhibiteurs de la DPP‑4 |
A10BH |
4 (4) |
4 |
9 |
9 |
253 164 481 $ |
1,8 % |
73 % |
66 625 261 $ |
| Facteurs stimulants de colonies |
L03AA |
4 (2) |
2 |
2 |
2 |
190 125 072 $ |
1,4 % |
64 % |
66 564 684 $ |
| Anticorps monoclonaux |
L01XC |
16 (11) |
10 |
11 |
3 |
693 886 828 $ |
4,9 % |
93 % |
59 115 151 $ |
| Glucocorticoïdes |
R03BA |
10 (5) |
9 |
15 |
10 |
186 643 090 $ |
1,3 % |
82 % |
57 781 683 $ |
| Inhibiteurs de la pompe à protons |
A02BC |
15 (6) |
8 |
14 |
11 |
310 660 124 $ |
2,2 % |
61 % |
51 551 686 $ |
| Associations d’hypoglycémiants oraux |
A10BD |
10 (5) |
5 |
18 |
10 |
191 094 966 $ |
1,4 % |
68 % |
46 742 800 $ |
Source : CEPMB
Utilisation faite des produits médicamenteux brevetés
Les données sur les prix et sur la valeur des ventes utilisées pour calculer l’IPMB servent également à déterminer les tendances dans les quantités de médicaments brevetés vendus au Canada. Le CEPMB calcule à cette fin l’indice du volume des ventes de médicaments brevetés (IVVMB). La figure 14 présente pour les années 1988 à 2015 les taux moyens de croissance de l’utilisation des produits médicamenteux brevetés, mesurée à l’aide de l’IVVMB. Les résultats obtenus confirment que, dans les dernières années, la croissance de l’utilisation faite des produits médicamenteux brevetés est le principal facteur d’augmentation de la valeur des ventes. Les taux de croissance de l’utilisation talonnent en effet de près les taux de croissance de la valeur des ventes. Cette tendance de suivi s’est maintenue en 2015, le taux d’utilisation des produits médicamenteux brevetés ayant augmenté, en moyenne, de 10,6 % entre 2014 et 2015 et les ventes ayant augmenté de 9,5 %.
Figure 14. Taux annuel de variation (%) de l’indice du volume des ventes de médicaments brevetés (IVVMB), 1988-2015
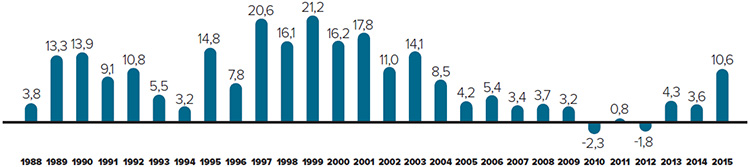
Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, les taux moyens de croissance de l’utilisation des produits médicamenteux brevetés, mesurés par l’indice de volume des ventes de médicaments brevetés (IVVMB), de 1998 à 2015.
1988 : 3,8; 1989 : 13,3; 1990 : 13,9; 1991 : 9,1; 1992 : 10,8; 1993 : 5,5; 1994 : 3,2; 1995 : 14,8; 1996 : 7,8; 1997 : 20,6; 1998 : 16,1; 1999 : 21,2; 2000 : 16,2; 2001 : 17,8; 2002 : 11,0; 2003 : 14,1; 2004 : 8,5; 2005 : 4,2; 2006 : 5,4; 2007 : 3,4; 2008 : 3,7; 2009 : 3,2; 2010 : -2,3; 2011 : 0,8; 2012 : -1,8; 2013 : 4,3; 2014 : 3,6; 2015 : 10,6.
Croissance de l’utilisation faite des produits médicamenteux brevetés selon le groupe thérapeutique
Le tableau 14 présente les taux moyens de croissance de l’utilisation faite des produits médicamenteux brevetés. Ces taux sont ventilés selon les groupes thérapeutiques principaux. Les résultats présentés dans ce tableau ont été obtenus en appliquant la méthodologie de l’IVVMB aux données du niveau 1 de la classification ATC. Comme dans le tableau 10, la dernière colonne donne un aperçu de la contribution des différents groupes thérapeutiques à la variation de l’IVVMB global.
En 2015, les niveaux d’utilisation ont augmenté dans huit groupes thérapeutiques. L’augmentation de l’utilisation faite de l’ensemble des produits est essentiellement attribuable à l’utilisation accrue des agents antinéoplasiques et immunomodulateurs, des antiinfectieux généraux et de produits antiparasitaires, ainsi que des produits agissant sur le tube digestif et le métabolisme.
Tableau 14. Variation de l’indice du volume des ventes de médicaments brevetés (IVVMB) selon le groupe thérapeutique principal, 2015
| Groupe thérapeutique |
Pourcentage des ventes
en 2015 (%) |
Variation du volume de
2014 à 2015 (%) |
Contribution : variation
de l’IVVMB (%) |
| A : Tube digestif et métabolisme |
10,6 |
11,22 |
1,19 |
| B : Sang et organes sanguinoformateurs |
5,1 |
5,13 |
0,26 |
| C : Système cardiovasculaire |
5,3 |
-11,99 |
-0,64 |
| D : Produits dermatologiques |
0,7 |
-1,17 |
-0,01 |
| G : Système génito-urinaire et hormones sexuelles |
3,5 |
0,18 |
0,01 |
| H : Préparations hormonales systémiques |
0,4 |
8,12 |
0,03 |
| J : Antiinfectieux généraux pour usage systémique |
15,8 |
50,57 |
7,99 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
31,2 |
13,16 |
4,11 |
| M : Système musculo-squelettaire |
2,4 |
-20,29 |
-0,49 |
| N : Système nerveux |
10,7 |
-4,47 |
-0,48 |
| R : Système respiratoire |
8,2 |
6,26 |
0,51 |
| S : Organes sensoriels |
5,2 |
10,32 |
0,54 |
| V : Divers |
1,0 |
8,53 |
0,09 |
| Tous les groupes thérapeutiques |
100,0† |
10,6 |
10,6 |
† Il se peut que les valeurs de cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Dépenses en produits médicamenteux au canada par rapport aux marchés mondiaux
IMS HealthNote de bas de page 20 fait régulièrement rapport des ventes de médicaments dans un grand nombre de pays. Selon les données sur les ventes provenant de cette source, la figure 15 illustre la répartition de ces ventes entre le Canada et les sept pays que le CEPMB utilise dans ses examens de prix (CEPMB7)Note de bas de page 21. En 2015, le marché canadien a représenté 2,0 % du marché mondial.
Figure 15. Distribution des ventes de produits médicamenteux entre les grands marchés nationaux, 2015
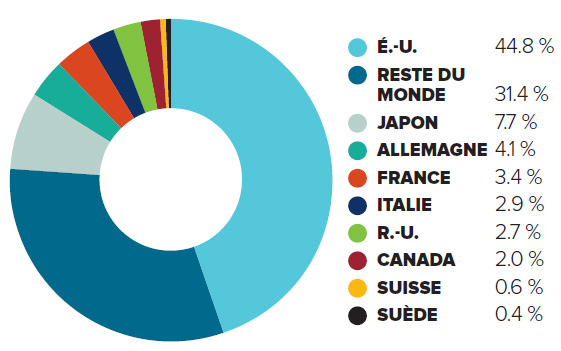
Source: Midas™ database, 2005-2015, IMS AG. All rights reserved.Note de bas de page 22
Description de la figure
Il s’agit d’un diagramme en secteurs présentant la distribution des ventes des médicaments parmi les principaux marchés mondiaux en 2015.
Le marché des É-U comptait pour 44,8 % du marché mondial 2015. Japon : 7,7 %; Allemagne : 4,1 %; France : 3,4 %; Italie : 2,9 %; Royaume-Uni : 2,7 %; Canada : 2,0 %; Suisse : 0,6 %; Suède : 0,4 %; reste du monde : 31,4 %.
La figure 16 présente la part des ventes du Canada sur les principaux marchés mondiaux de 2005 à 2015. Pendant toutes ces années, la part des ventes du Canada s’est maintenue entre 2,0 % et 2,7 %. La part de marché moyenne de 2,0 % observée au cours des dernières années représente une part relativement faible pour le Canada et fait état d’une diminution pour la cinquième année consécutive, mais cette tendance découle de l’augmentation rapide des prix aux États-Unis, qui a fait augmenter la part des États-Unis de 40,4 % en 2014 à 44,8 % en 2015, ce qui a entraîné la baisse des parts de tous les autres grands marchés nationaux.
Figure 16. Pourcentage des ventes de produits médicamenteux du Canada, 2005-2015
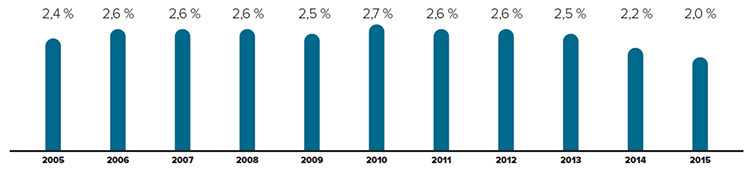
Source : Base de données MIDASMC, 2005-2015, IMS AG. Tous droits réservés.Note de bas de page 23
Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, la part des ventes du Canada sur les marchés mondiaux, de 2005 à 2015.
2005 : 2,4; 2006 : 2,6; 2007 : 2,6; 2008 : 2,6; 2009 : 2,5; 2010 : 2,7; 2011 : 2,6; 2012 : 2,6; 2013 : 2 5; 2014 : 2,2; 2015 : 2,0.
La figure 17 compare la croissance annuelle des ventes de produits médicamenteux au Canada à celle des sept pays de comparaison, ensemble et séparément (CEPMB7). Entre 2005 et 2015, les ventes de produits médicamenteux au Canada ont augmenté à un taux annuel moyen de près de 4,2 %. Ce taux est inférieur au taux moyen de croissance des ventes dans les sept pays de comparaison pour la même période; cependant, comme l’indique clairement la figure, le taux de croissance est grandement faussé par l’influence des ventes des États-Unis sur le total des recettes des pays du CEPMB7.
Figure 17. Taux moyen de croissance (%) des ventes de produits médicamenteux aux taux de change constants du marché de 2015, par pays, 2005-2015
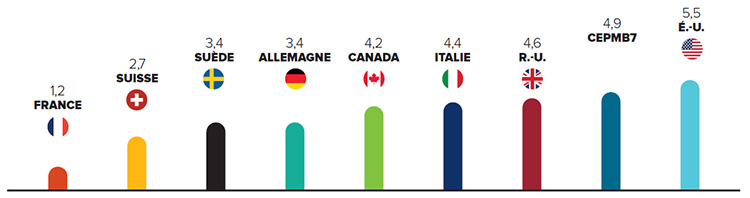
Source : Base de données MIDASMC, 2005-2015, IMS AG. Tous droits réservés.Note de bas de page 24
Description de la figure
Il s’agit d’un diagramme à barres présentant, en pourcentage, la croissance moyenne annuelle des ventes totales de produits médicamenteux pour le Canada et les sept autres pays de comparaison, individuellement et collectivement, de 2005 à 2015.
France : 1,2; Suisse : 2,7; Suède : 3,4; Allemagne : 3,4; Canada : 4,2; Italie : 4,4; Royaume-Uni : 4,6; CEPMB7 : 4,9; États-Unis : 5,5.
La figure 18 compare les taux annuels de croissance des ventes de produits médicamenteux au Canada et dans l’ensemble des pays de comparaison (CEPMB7). En 2015, pour la sixième année consécutive, les ventes ont augmenté à un taux plus lent au Canada que dans l’ensemble des pays de comparaison. Toutefois, comme mentionné dans les explications des figures 11 et 12, la présence des États-Unis fausse les résultats. Par conséquent, la médiane du taux de croissance des dépenses des pays du CEPMB7 a été ajoutée à la figure, qui illustre que le taux de croissance des dépenses du Canada a suivi de près celui des pays du CEPMB7 depuis 2010.
Figure 18. Taux moyen annuel de variation des ventes de produits médicamenteux aux taux de change constants du marché de 2015, au Canada et dans les pays de comparaison, 2006-2015
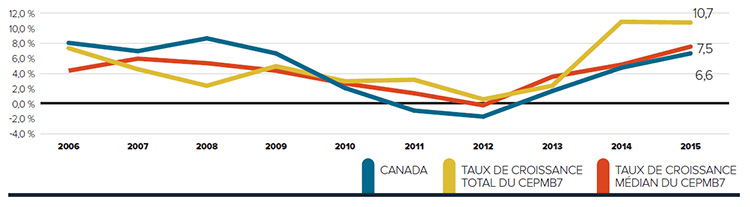
Source : Base de données MIDASMC, 2005-2015, IMS AG. Tous droits réservés.Note de bas de page 25
Description de la figure
La figure 18 est un diagramme linéaire qui compare le taux moyen annuel de variation des ventes de médicaments, aux taux de change constants du marché de 2015, au Canada par rapport à l’ensemble des pays de comparaison (CEPMB7) et au taux de croissance des ventes médian du CEPMB7, entre 2006 et 2015.
2006 : Canada 8,0, Pays de comparaison 7,3, Médiane des pays de comparaison 4,3;
2007 : Canada 6,9, Pays de comparaison 4,5, Médiane des pays de comparaison 5,9;
2008 : Canada 8,6, Pays de comparaison 2,3, Médiane des pays de comparaison 5,3;
2009 : Canada 6,6, Pays de comparaison 4,3, Médiane des pays de comparaison 4,9;
2010 : Canada 2,0, Pays de comparaison 2,8, Médiane des pays de comparaison 2,6;
2011 : Canada -1,0, Pays de comparaison 3,1, Médiane des pays de comparaison 1,3;
2012 : Canada -1,8, Pays de comparaison 0,5, Médiane des pays de comparaison -0,3;
2013 : Canada 1,6, Pays de comparaison 2,3, Médiane des pays de comparaison 3,5;
2014 : Canada 4,7, Pays de comparaison 10,8, Médiane des pays de comparaison 5,1;
2015 : Canada 6,6, Pays de comparaison 10,7, Médiane des pays de comparaison 7,5;
La comparaison des dépenses en produits médicamenteux entre les pays peut aussi être faite à l’aide de la proportion du revenu national consacrée à l’achat de médicamentsNote de bas de page 26. La figure 19 présente les dépenses en produits médicamenteux exprimées en pourcentage du produit intérieur brut (PIB) du Canada et des sept pays de comparaison (selon des données de 2013). Dans les sept pays de comparaison, les dépenses en produits médicamenteux ont accaparé entre 1,0 % et 2,0 % du PIB. Sur cette échelle, la valeur du Canada (1,8 %) s’inscrit près de la limite supérieure.
Figure 19. Dépenses en produits médicamenteux, exprimées en pourcentage du PIB, 201
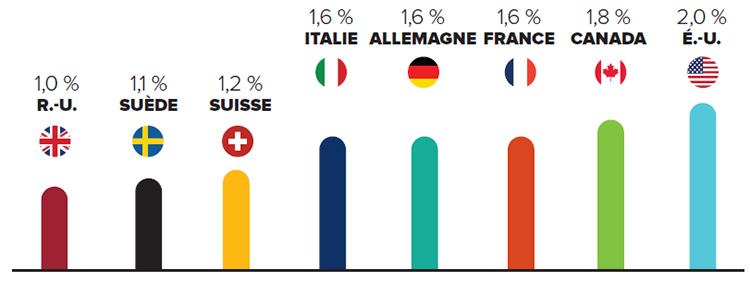
Description de la figure
Il s’agit d’un diagramme à barres présentant les dépenses en produits médicamenteux en pourcentage du produit intérieur brut (PIB) pour le Canada et les sept pays de comparaison, selon les données de 2013.
Royaume-Uni : 1,0; Suède : 1,1; Suisse : 1,2; Italie : 1,6; Allemagne : 1,6; France : 1,6; Canada : 1,8; États-Unis : 2,0.
Le tableau 15 présente le ratio des dépenses par rapport au PIB dans son contexte historique. En 2005, le ratio du Canada se situait au quatrième rang parmi les pays du CEPMB7. Depuis, le ratio du Canada a augmenté, alors que les ratios de quatre autres pays (la France, l’Allemagne, l’Italie et la Suède) ont diminué. En outre, le Canada arrive deuxième en ce qui concerne les dépenses les plus élevées en médicaments par habitant parmi les pays du CEPMB7 (après les États-Unis), soit 22 % au-dessus de la médiane de ces pays.
Le tableau 16 présente la distribution des ventes par les brevetés selon le groupe thérapeutique au Canada, dans chaque pays de comparaison ainsi que dans l’ensemble des pays de comparaison (CEPMB7)Note de bas de page 27. Les résultats font ressortir un degré d’uniformité remarquable entre les différents pays.
Tableau 15. Dépenses en produits médicamenteux, exprimées en pourcentage du PIB, 2013Note de bas de page 28
|
Part des dépenses en produits médicamenteux, 2013
(% du PIB) |
Part des dépenses en produits médicamenteux, 2005
(% du PIB) |
Croissance des dépenses en produits médicamenteux,
2005-2013 (%) |
Dépenses en médicaments par habitant (PPA US$) |
| Canada |
1,78 |
1,64 |
33,3 |
761 |
| France |
1,65 |
1,79 |
34,6 |
622 |
| Allemagne |
1,55 |
1,58 |
36,7 |
678 |
| Italie |
1,63 |
1,70 |
25,1 |
572 |
| Suède |
1,11 |
1,15 |
39,6 |
496 |
| Suisse |
1,22 |
1,09 |
64,9 |
696 |
| Royaume-Uni |
1,04 |
1,00 |
19,9 |
367 |
| États-Unis |
1,95 |
1,88 |
27,3 |
1 034 |
Source : OCDE
Tableau 16. Distribution des ventes de produits médicamenteux (en %) selon le groupe thérapeutique principal, au Canada et dans les pays de comparaison, 2015
| Therapeutic Class |
Canada |
CEPMB7 |
France |
Italie |
Allemagne |
Suède |
Suisse |
Royaume-Uni |
États-Unis |
| A : Tube digestif et métabolisme |
12,6 |
13,6 |
10,0 |
10,4 |
11,1 |
9,4 |
10,8 |
10,8 |
14,6 |
| B : Sang et organes sanguinoformateurs |
4,3 |
4,9 |
7,5 |
8,1 |
6,9 |
8,0 |
5,5 |
5,0 |
4,3 |
| C : Système cardiovasculaire |
9,8 |
7,5 |
9,4 |
10,6 |
7,2 |
4,7 |
9,7 |
6,8 |
7,2 |
| D : Produits dermatologiques |
3,2 |
3,0 |
2,4 |
2,0 |
2,7 |
2,6 |
3,5 |
3,0 |
3,2 |
| G : Système génito-urinaire et hormones sexuelles |
4,8 |
4,4 |
3,0 |
3,5 |
3,2 |
4,0 |
4,3 |
3,7 |
4,8 |
| H : Préparations hormonales systémiques |
1,2 |
2,3 |
2,2 |
1,8 |
2,0 |
2,3 |
1,6 |
3,1 |
2,3 |
| J : Antiinfectieux généraux pour usage systémique |
10,3 |
13,6 |
13,8 |
19,4 |
12,3 |
12,9 |
12,5 |
11,0 |
13,5 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
18,7 |
19,2 |
20,3 |
17,3 |
22,7 |
23,1 |
21,2 |
20,1 |
18,8 |
| M : Système musculo-squelettaire |
3,1 |
3,1 |
3,0 |
3,3 |
3,8 |
3,4 |
5,2 |
2,5 |
3,0 |
| N : Système nerveux |
16,9 |
15,2 |
13,5 |
10,5 |
12,9 |
16,6 |
14,4 |
17,3 |
15,7 |
| P : Produits antiparasitaires |
0,2 |
0,2 |
0,2 |
0,0 |
0,1 |
0,2 |
0,1 |
0,2 |
0,3 |
| R : Système respiratoire |
7,2 |
6,8 |
5,9 |
5,3 |
6,7 |
7,0 |
6,0 |
8,6 |
6,9 |
| S : Organes sensoriels |
4,1 |
2,6 |
3,3 |
2,1 |
2,9 |
3,0 |
4,0 |
4,3 |
2,4 |
| V : Divers |
3,7 |
3,4 |
5,3 |
5,7 |
5,4 |
2,9 |
1,4 |
3,8 |
2,9 |
| Tous les groupes thérapeutiques† |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
100,0 |
† Il se peut que les valeurs ne totalisent pas 100,0 en raison de l’arrondissement.
Source : Base de données MIDASMC, 2005-2015, IMS AG. Tous droits réservés.Note de bas de page 29
Le Système national d’information sur l’utilisation des médicaments prescrits : À l’appui des décisions relatives aux soins de Santé au Canada
La façon dont les médicaments sont utilisés – où, par qui et dans quel but – influe sur les dépenses canadiennes en matière de médicaments. Le CEPMB permet au Canada de mieux comprendre les tendances par le biais du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), qui produit des renseignements complets et exacts permettant d’orienter le processus décisionnel et de favoriser la viabilité soutenue de notre système pharmaceutique.
Le CEPMB collabore avec les provinces et les territoires.
Des rapports du CEPMB ont été utilisées par les provinces et les territoires dans le cadre des efforts de l’Alliance pancanadienne pharmaceutique en vue de réduire les prix des médicaments de marque et génériques.
Contexte
Le Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) est une initiative de recherche mise sur pied par les ministres fédéral, provinciaux et territoriaux de la Santé en septembre 2001. Il s’agit d’un partenariat entre le CEPMB et l’Institut canadien d’information sur la santé (ICIS).
Il vise à fournir aux décideurs et aux gestionnaires des régimes publics d’assurance-médicaments des analyses critiques des tendances relatives aux prix, à l’utilisation et aux coûts des médicaments, afin de s’assurer que le système canadien des soins de santé a accès à des renseignements exhaustifs et précis sur l’utilisation des médicaments d’ordonnance et sur les facteurs à l’origine des augmentations des coûts.
Le Comité consultatif du SNIUMP, constitué de représentants des régimes publics d’assurance-médicaments de la Colombie-Britannique, de l’Alberta, de la Saskatchewan, du Manitoba, de l’Ontario, du Nouveau-Brunswick, de la Nouvelle-Écosse, de l’Île-du-Prince-Édouard, de Terre-Neuve-et-Labrador, du Yukon et de Santé Canada, conseille le CEPMB sur son programme de recherche et lui suggère des sujets d’étude. Le Comité comprend également des observateurs de l’ICIS et de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS).
Faits saillants
Depuis le dernier rapport annuel, le CEPMB a publié quatre rapports analytiques et sept affiches au titre du SNIUMP :
- L’Observateur des médicaments émergents, 7e édition
- Les régimes privés d’assurance-médicaments au Canada – Partie 1 : Marché des médicaments génériques, 2005-2013
- Génériques360 – Médicaments génériques au Canada, 2014
- CompasRx : Rapport annuel sur les dépenses des régimes publics d’assurance-médicaments, 2e édition
Présentations par affiche :
- Pressions sur les coûts du marché pharmaceutique des hôpitaux du Canada, 2006-2014
- Utilisation des médicaments contre le diabète dans les régimes publics d’assurance-médicaments du Canada
- Les facteurs de coût des régimes privés d’assurance-médicaments au Canada, de 2008 à 2015
- Régimes privés d’assurance-médicaments au Canada : médicaments et bénéficiaires à coûts élevés, de 2005 à 2015
- L’Observateur des nouveaux médicaments lancés sur le marché, 2009-2015
- L’Observateur des médicaments orphelins lancés sur le marché, 2005-2014
- Pressions exercées sur les coûts des nouveaux médicaments contre l’hépatite C au Canada
Le CEPMB a également réalisé un certain nombre d’études spéciales à la demande des juridictions participant au SNIUMP à l’appui de leur prise de décisions stratégiques.
Le CEPMB a continué de soutenir et de renforcer ses activités d’engagement liées au SNIUMP en consultant régulièrement le Comité consultatif du SNIUMP, en participant à des conférences et des comités d’intervenants, en organisant des séances d’échange d’information avec des chercheurs et en organisant des séances d’information avec des intervenants souhaitant partager les résultats des études analytiques.
Le résumé des trois plus récents rapports est présenté dans le présent rapport.
Les régimes privés d’assurance-médicaments au Canada – Partie 1 : Marché des médicaments génériques, 2005-2013

Les régimes privés d’assurance-médicaments au Canada – Partie 1 : Marché des médicaments génériques, 2005-2013 est le premier d’une série de trois rapports publiée par le CEPMB qui analyse les tendances des régimes privés d’assurance-médicaments du Canada. Les deux autres rapports à venir porteront sur les facteurs de coût et les médicaments onéreux. Cette série présente aux décisionnaires et aux chercheurs une perspective sur les sources de pressions liées aux coûts et les possibilités en matière d’économies de coûts.
Ce rapport évalue les parts de marché des médicaments génériques en pleine évolution et les coûts remboursés par unité des régimes privés d’assurance-médicaments, ainsi que les schémas de délivrance et leurs répercussions sur les coûts totaux des ordonnances. Par ailleurs, l’étude propose une analyse comparative avec les régimes publics d’assurance-médicaments du Canada et avec certains pays.
Parts des médicaments génériques dans les ordonnances, régimes privés, 2013
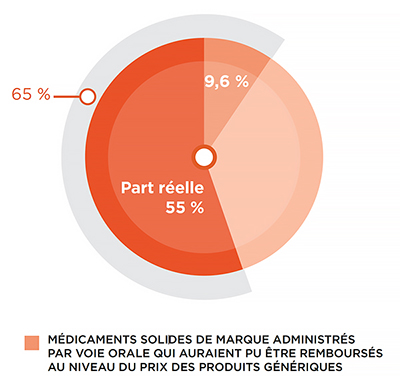
Remarque : Les résultats estimés se limitent aux médicaments solides administrés par voie orale existant en versions de marque et générique et faisant l’objet de plus de 1 000 ordonnances par année.
Source de données : Base de données des régimes privés d’assurance-médicaments d’IMS Brogan.
Description de la figure
Le diagramme à secteurs présente la part des médicaments génériques solides, administrés par voie orale, dans les ordonnances pour les régimes privés d’assurance-médicaments au Canada. En 2013, les médicaments génériques comptaient pour 55 % des ordonnances. En outre, 9,6 % des ordonnances concernaient des médicaments de marque pour lesquels il y avait des médicaments génériques équivalents. Si ces médicaments avaient été remboursés en fonction du prix des médicaments génériques, la part des médicaments génériques aurait été de 65 %.
Principales constatations
- Les médicaments génériques comptaient pour 70 % de tous les médicaments prescrits au Canada en 2013. Le Canada arrivait en troisième place pour le pourcentage sur une base annuelle d’ordonnances de produits génériques comparativement aux pays du CEPMB7.
- Le pourcentage d’ordonnances de produits génériques remboursées par les régimes privés d’assurance médicaments canadiens est passé de 37 % en 2005 à 55 % en 2013, mais est toujours inférieur à celui des génériques remboursés par les régimes publics (71 %), surtout en raison des différences de profils démographique et pathologique des populations de bénéficiaires.
- En 2013, si les régimes privés avaient limité le remboursement des médicaments solides de marque administrés par voie orale au prix des produits génériques, jusqu’à 9,6 % des ordonnances auraient été visés. La part des ordonnances faisant l’objet d’un remboursement au niveau du prix des produits génériques aurait alors grimpé à 65 %, ce qui aurait entraîné une réduction des coûts de détail des médicaments pouvant atteindre 5,7 %.
- Les régimes privés d’assurance-médicaments canadiens offraient un remboursement de 5 à 12 % inférieur par ordonnance de produit générique comparativement aux régimes publics en 2013, en raison des délivrances moins fréquentes et des moindres frais de délivrance.
- Les politiques d’établissement des prix de génériques mises en place par la plupart des gouvernements provinciaux ont grandement réduit le prix des produits génériques remboursés par les régimes privés d’assurance-médicaments. En effet, ce prix est passé en moyenne de 63 % du prix de référence en 2010 à 42 % de ce prix en 2013, ce qui a entraîné des économies de 8 à 13 % du coût global des médicaments au détail en 2013.
- La fréquence de délivrance constitue un facteur clé ayant contribué à faire grimper le coût d’ordonnance des produits génériques dans les régimes d’assurance-médicaments privés du Québec, à des niveaux supérieurs de 64 % à ceux de l’Ontario. En moyenne, 35 unités de médicaments solides administrés par voie orale ont été dispensées sur ordonnance dans des régimes privés au Québec, ce qui est largement inférieur à la moyenne de 64 unités pour l’Ontario.
Génériques360 – Médicaments génériques au Canada, 2014

Génériques360 fait partie d’une série de rapports rédigés par le CEPMB qui fait état des plus récents développements en ce qui a trait à l’établissement des prix des médicaments génériques au Canada et compare ces prix à ceux des autres pays industrialisés. Le présent rapport met à jour la précédente recherche du CEPMB en présentant les dernières tendances en matière d’établissement des prix des médicaments génériques à l’échelle nationale, tendances qui combinent tous les segments du marché, c’est-à-dire publics, privés et directs. Le prix des médicaments génériques au Canada est une question cruciale pour les gestionnaires des régimes d’assurance-médicaments, les décideurs et les consommateurs.
Les politiques provinciales en matière de prix des médicaments génériques, notamment celles mises en œuvre par l’Alliance pancanadienne pharmaceutique, ont permis de réaliser d’importantes réductions de prix au Canada. Bien que ces baisses de prix aient dépassé les réductions de prix des médicaments génériques sur les marchés étrangers au cours des dernières années, les prix des médicaments génériques demeurent beaucoup plus élevés au Canada qu’à l’étranger.
Ratios moyens des prix des médicaments génériques par rapport aux médicaments de marque, Canada, T1-2010 à T4-2014
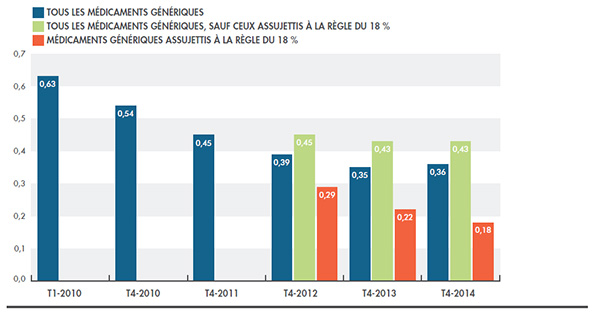
Source: Base de données MIDASMC, janvier-mars 2010 à octobre-décembre 2014, IMS AG. Tous droits réservés.
Description de la figure
Ce graphique de barres décrit la tendance à la baisse du ratio moyen des prix des médicaments génériques par rapport à ceux des médicaments de marque au Canada de 2010 à 2014 compte tenu de tous les médicaments génériques inclus dans l’analyse. Les valeurs sont présentées pour le premier et le quatrième trimestre de 2010 et pour le quatrième trimestre de toutes les autres années (2011 à 2014).
Pour la période de 2012 à 2014, les valeurs sont aussi ventilées de façon à indiquer le ratio des prix des médicaments génériques par rapport à ceux des médicaments de marque dans le cas des médicaments génériques assujettis à la règle des 18 % et dans celui des autres médicaments qui ne le sont pas.
Ratios des prix des médicaments génériques par rapport à ceux des médicaments de marque pour tous les médicaments inclus dans la présente analyse
- Premier trimestre de 2010 : 0,63
- Quatrième trimestre de 2010 : 0,54
- Quatrième trimestre de 2011 : 0,45
- Quatrième trimestre de 2012 : 0,39
- Quatrième trimestre de 2013 : 0,35
- Quatrième trimestre de 2014 : 0,36
Ratios des prix des médicaments génériques par rapport à ceux des médicaments de marque assujettis à la règle des 18 %
- Quatrième trimestre de 2012 : 0,29
- Quatrième trimestre de 2013 : 0,22
- Quatrième trimestre de 2014 : 0,18
Ratios des prix des médicaments génériques par rapport à ceux des médicaments de marque pour tous les médicaments sauf ceux qui sont assujettis à la règle des 18 %
- Quatrième trimestre de 2012 : 0,45
- Quatrième trimestre de 2013 : 0,43
- Quatrième trimestre de 2014 : 0,43
Principales constatations
- Les prix moyens des médicaments génériques au Canada sont passés de 63 % à 36 % comparativement à ceux des produits de marque entre 2010 et 2014.
- L’écart entre les prix des médicaments génériques des marchés canadiens et étrangers a graduellement diminué, pour passer de 40 % en 2010 à 19 % en 2014. La majeure partie de cette réduction a été réalisée à la fin de 2013.
- La faiblesse du dollar canadien a aussi contribué à la diminution de l’écart entre les prix des médicaments génériques au Canada et à l’étranger, mais l’ampleur de cette diminution a été annulée en partie par une réduction correspondante des prix à l’étranger.
- L’écart entre les prix des médicaments génériques était plus marqué pour les médicaments dont les ventes annuelles estimées au Canada s’élevaient à plus de dix millions de dollars et pour les médicaments fournis par six fournisseurs ou plus, avec des prix moyens à l’étranger de 25 et 21 % moins élevés qu’au Canada, respectivement. Ces marchés représentaient une large part des ventes de produits génériques.
Ratios multilatéraux moyens des prix étrangers des médicaments génériques par rapport aux prix canadiens, CEPMB7*, de T4-2010 à T4-2014
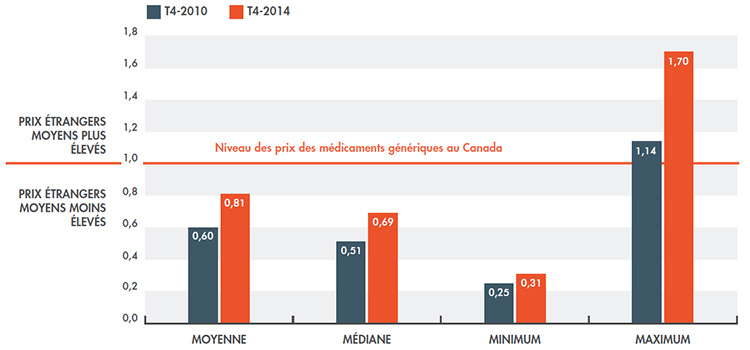
France, Allemagne, Italie, Suède, Suisse, Royaume-Uni et États-Unis
Source : MIDAS™, octobre-décembre 2010 à octobre-décembre 2014, IMS AG Tous droits réservés.
Description de la figure
Ce graphique de barres présente les ratios moyen, médian, minimum et maximum des prix étrangers par rapport aux prix canadiens pour les quatrième trimestres de 2010 et 2014. Le niveau des prix des médicaments génériques canadiens est fixé à un. Les ratios qui dépassent un indiquent des prix étrangers moyens plus élevés, tandis que ceux qui n’atteignent pas un indiquent des prix étrangers plus faibles.
Le ratio moyen des prix étrangers par rapport aux prix canadiens s’établissait à 0,60 en 2010, et 0,81 en 2014.
Le ratio médian des prix étrangers par rapport aux prix canadiens s’établissait à 0,51 en 2010, et 0,69 en 2014.
Le ratio minimum des prix étrangers par rapport aux prix canadiens s’établissait à 0,25 en 2010, et 0,31 en 2014.
Le ratio maximum des prix étrangers par rapport aux prix canadiens s’établissait à 1,14 en 2010, et 1,70 en 2014.
CompasRx, 2e édition: Rapport annuel sur les dépenses des régimes publics d’assurance médicaments, 2013-2014

CompasRx est un rapport annuel phare et le premier du genre à cerner et décomposer les principaux facteurs ayant une incidence sur les dépenses en médicaments d’ordonnance au sein des régimes publics d’assurance-médicaments au Canada. Il permet aux décideurs et aux chercheurs de mieux comprendre les tendances de l’heure et de prévoir les pressions exercées par les futurs coûts et niveaux de dépenses.
CompasRx de 2013-2014 est la deuxième édition de ce rapport. Il décrit les nouvelles tendances démographiques, d’établissement des prix et d’utilisation de médicaments en se basant sur le niveau de référence établi dans la publication de 2012-2013. Le rapport surveille également les principaux faits nouveaux qui ont trait à l’approbation, à l’examen, à l’établissement du prix et au remboursement des médicaments au Canada. Deux nouvelles administrations ont été ajoutées à cette édition, ce qui permet d’offrir une vision plus globale de l’environnement des régimes publics.
Inducteurs des coûts des médicaments, 2012-2013 et 2013-2014
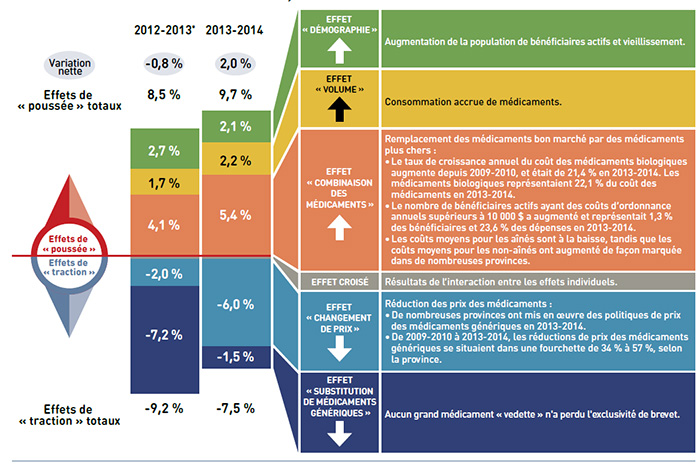
Nota :Les valeurs peuvent ne pas correspondre aux totaux parce qu’elles ont été arrondies et en raison des effets croisés.
Source des données : Base de données du Système national d’information sur l’utilisation des médicaments prescrits, Institut canadien d’information sur la santé (ICIS), laquelle comprend les régimes publics d’assurance-médicaments suivants : Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve-et-Labrador et programme d’assurance-médicaments des services de santé non assurés de Santé Canada.
Veuillez noter que les résultats de 2012-2013 ne tiennent pas compte des données des régimes publics d'assurance-médicaments de la Colombie-Britannique et de Terre-Neuve-et-Labrador.
Description de la figure
Le diagramme illustre les inducteurs de coût des médicaments de 2013-2014 et les compare avec les résultats globaux de 2012-2013 pour les régimes publics d’assurance-médicaments du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) au Canada. Les inducteurs de coût sont classés en deux catégories : effet de poussée (augmentation) et effet de traction (diminution).
La variation nette globale des coûts des médicaments entre 2012-2013 et 2013-2014 était de 2,0 %, par rapport à -0,8 % entre 2011-2012 et 2012-2013.
En 2013-2014, l’effet de poussée total était de 9,7 % (par rapport à 8,5 % en 2012-2013) et comprenait les principaux effets suivants :
- l’effet « démographie » était de 2,1 % en raison de la croissance de la population de bénéficiaires actifs et du vieillissement. En 2012-2013, il s’établissait à 2,7 %;
- l’effet « volume » était de 2,2 % en raison du recours accru aux médicaments, alors qu’il se chiffrait à 1,7 % en 2012-2013;
- l’effet « combinaison de médicaments » était de 5,4 % (par rapport à 4,1 % en 2012-2013) en raison du remplacement des médicaments bon marché par des médicaments plus chers.
- Le taux de croissance annuel des médicaments biologiques a augmenté depuis 2009-2010 et se chiffrait à 21,4 % en 2013-2014. Les médicaments biologiques représentaient 22,1 % du coût des médicaments en 2013-2014.
- Le nombre de bénéficiaires actifs ayant des coûts d’ordonnance annuels supérieurs à 10 000 $ a augmenté et représentait 1,3 % des bénéficiaires et 23,6 % des dépenses en 2013-2014.
- Les coûts annuels moyens pour les aînés ont baissé, alors que les coûts moyens annuels des non-aînés ont augmenté considérablement dans de nombreuses provinces.
L’effet de traction total était de -7,5 % (par rapport à -9,2 % en 2012-2013) et comprenait les principaux effets suivants :
- l’effet « changement de prix » était de -6,0 % (par rapport à -2,0 % en 2012-2013) en raison d’une réduction des prix des médicaments;
- de nombreuses provinces ont mis en œuvre des politiques relatives aux prix des médicaments génériques en 2013-2014;
- entre 2009-2010 et 2013-2014, les réductions des prix des médicaments génériques se situaient dans une fourchette de 34 % à 57 %, selon la province;
- l’effet « substitution de médicaments génériques » était de -1,5 % (par rapport à -7,2 % en 2012-2013), étant donné que l’exclusivité des brevets n’est venue à échéance pour aucun médicament-vedette en 2013-2014.
Un effet croisé a résulté de l’interaction entre les effets individuels. Aucune valeur n’est accordée à l’effet croisé.
Principales constatations
- En 2013-2014, les dépenses en médicaments d’ordonnance des régimes publics d’assurance-médicaments analysés ont totalisé 9,8 milliards de dollars, montant constitué des coûts des médicaments (74,2 %), des frais d’exécution des pharmacies (22,3 %) et des marges bénéficiaires (3,5 %).
- Les régimes publics d’assurance-médicaments ont payé 78,7 % du total des dépenses en médicaments prescrits, tandis que les bénéficiaires ont payé le reste soit directement, soit par l’intermédiaire d’un assureur privé tiers.
- Tandis que les taux moyens de variation de l’élément coût des médicaments de tous les régimes publics du SNIUMP ont diminué régulièrement de 2010-2011 à 2012-2013 pour atteindre un creux de -1,5 %, cette tendance s’est inversée en 2013-2014, alors que les coûts moyens de médicaments ont connu une hausse de 2,0 %.
- Le faible taux de variation nette découle d’effets de « poussée » (à la hausse) et de « traction » (à la baisse) qui s’opposent.
- Les effets « démographiques », « volume » et « combinaison des médicaments » ont exercé un important effet de poussée et sans les économies permises par les médicaments génériques, ces facteurs auraient propulsé le niveau des coûts des médicaments de 9,7 % en 2013-2014.
- La variation moyenne des prix des médicaments génériques et les répercussions des substitutions ont exercé un important effet de « traction » et sans les autres pressions qui ont agi sur les coûts, ces facteurs auraient fait baisser les niveaux des coûts des médicaments de 7,5 % en 2013-2014.
Programme de recherche
Le programme de recherche du SNIUMP pour les deux prochains exercices financiers comprend les études analytiques suivantes :
- CompasRx du SNIUMP, 3e édition
- L’Observateur des médicaments émergents, 8e édition
- Veille des médicaments mis en marché, 1re édition
- Les régimes privés d’assurance-médicaments au Canada – Partie 2 : Analyse des facteurs de coûts, 2015
- Les régimes privés d’assurance-médicaments au Canada – Partie 3 : Médicaments et bénéficiaires à coûts élevés, 2015
- Utilisation et coûts des produits biologiques, de 2005-2006 à 2012-2013
- Économies potentielles associées aux produits biologiques ultérieurs : une analyse de l’incidence budgétaire canadienne
- Le paysage du remboursement des médicaments au Canada : un examen des marchés public et privé
D’autres sujets de recherche peuvent être traités après consultation du Comité consultatif du SNIUMP.
Analyse des dépenses de recherche-développement : Les investissements en R-D tombent en deçà de la cible
L’innovation est cruciale pour la promotion des soins de santé. La Loi sur les brevets du Canada vise, en partie, à créer un climat d’investissement propice à la recherche et au développement (R-D) dans le domaine pharmaceutique au Canada. Toutefois, le pourcentage de dépenses effectuées en R-D par rapport aux ventes chez les titulaires de brevets pharmaceutiques au Canada diminue depuis la fin des années 1990 et se situe sous l’objectif convenu de 10 % depuis 2003. En 2015, ce pourcentage équivalait à 4,4 % chez tous les titulaires de brevets, et à 4,9 % chez les brevetés membres de Médicaments novateurs Canada (anciennement Compagnies de recherche pharmaceutique du Canada).
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes de 4,4 %
En 2015, le ratio des dépenses de R-D par rapport aux recettes tirées des ventes pour tous les brevetés était de 4,4 %
Cela représente une diminution de 62 % par rapport au maximum de 11,7 % en 1995.
Le ratio moyen de R-D du CEPMB7 est 5x supérieur à celui du Canada
Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes obtenu par agrégation des dépenses de R-D et des ventes dans l’ensemble des sept pays de comparaison était 22,8 %, soit plus de cinq fois celui du Canada.
Analyse des dépenses de recherche-développement
La Loi sur les brevets (la Loi) confère au CEPMB le mandat de faire le suivi des dépenses des brevetés en recherche-développement (R-D) et de faire rapport des tendances observées. Le présent chapitre fournit des statistiques clés sur la situation actuelle des investissements dans la R-D pharmaceutique au Canada.
Sources des données
Les résultats statistiques présentés dans le présent rapport ont été entièrement tirés des données que les brevetés ont soumises au CEPMB.
La Loi oblige les brevetés à faire rapport au CEPMB des recettes brutes totales qu’ils tirent des ventes de tous leurs produits médicamenteux pour usage humain et pour usage vétérinaire (y compris les recettes tirées des ventes de produits médicamenteux non brevetés et les recettes découlant d’ententes de production sous licence) ainsi que de leurs dépenses de R-D au Canada pour leurs différents produits médicamenteux (brevetés et non brevetés, pour usage humain et pour usage vétérinaire). Les brevetés transmettent ces renseignements au CEPMB au moyen de son Formulaire 3 (Recettes et dépenses en recherche et développement fournies en application du paragraphe 88(1) de la Loi sur les brevets).
Le Règlement sur les médicaments brevetés (le Règlement) exige que chaque Formulaire 3 déposé soit accompagné d’un document certifiant l’exactitude et la conformité des données fournies. Le CEPMB ne vérifie pas systématiquement l’information qui lui est présentée sur le Formulaire 3, mais cherche plutôt les anomalies et les contradictions et, lorsqu’il y a lieu, demande aux brevetés de corriger leurs données ou de les étoffer. Pour garantir la juste interprétation des données de la part du personnel du CEPMB, chaque breveté est invité à vérifier et à confirmer, avant la publication du ratio, l’exactitude du ratio de ses dépenses de R-D par rapport aux recettes tirées des ventes.
Défaut de soumettre son rapport sur ses dépenses de R-D (Formulaire 3)
Les brevetés sont tenus de soumettre un Formulaire 3 complet et exact dans les délais mentionnés dans le Règlement. Si un breveté omet de respecter les exigences en matière de présentation de rapport, le Conseil peut rendre une ordonnance exigeant le respect de ces exigences. Le Conseil n’a pas été appelé à rendre des ordonnances pour la période de déclaration de 2015.
Couverture
Notons que les sociétés pharmaceutiques qui n’ont fait aucune vente de médicaments brevetés ne sont pas tenues de présenter un rapport sur leurs dépenses de R-D au CEPMB. Cela a deux conséquences.
D’abord, les résultats statistiques indiqués ici ne devraient pas être utilisés afin de couvrir toute la recherche pharmaceutique réalisée au Canada. Par exemple, une société peut vendre uniquement des produits médicamenteux non brevetés, mais effectuer quand même beaucoup de recherche au Canada. De même, une société peut effectuer de la recherche et ne vendre aucun produitNote de bas de page 30. Les résultats présentés ci-dessous ne tiendront pas compte des dépenses de R-D des entreprises dans l’une ou l’autre de ces situations.
Ensuite, comme de nouveaux produits médicamenteux brevetés sont entrés dans le marché canadien et que des brevets existants expirent, le nombre et l’identité des sociétés pharmaceutiques ayant soumis un rapport sur leurs activités de R-D peuvent varier d’année en année. Au total, 77 sociétés ont déclaré leurs activités de R-D en 2015. Parmi celles-ci, 33 étaient membres de Médicaments novateurs Canada (anciennement Compagnies de recherche pharmaceutique du Canada (Rx&D)).
Définition de recettes tirées des ventes
Aux fins du présent rapport, les recettes tirées des ventes s’entendent du produit brut total des ventes au Canada de tous les produits médicamenteux ainsi que des recettes découlant d’ententes de vente sous licence (p. ex. redevances et droits versés au breveté liés aux ventes effectuées au Canada par des titulaires de licence).
Définition de dépenses de R-D
En vertu de l’article 6 du Règlement, les brevetés doivent inclure dans leurs rapports leurs dépenses de R-D qui auraient été admissibles au crédit d’impôt à l’investissement pour la recherche scientifique et le développement expérimental (RS-DE) aux termes de la Loi de l’impôt sur le revenu, dans sa version qui est entrée en vigueur le 1er décembre 1987Note de bas de page 31. Ainsi, les dépenses de R-D peuvent inclure les dépenses courantes, les coûts d’immobilisation et l’amortissement autorisé. Les frais engagés pour les études de marché, la promotion des ventes, le contrôle de la qualité ou les essais systématiques de matériel, de dispositifs ou de produits ainsi que pour la collecte de données de routine n’étant pas admissibles au crédit d’impôt à l’investissement, ils ne doivent pas figurer dans les dépenses de R-D déclarées par les brevetés.
Recettes tirées des ventes et dépenses de R-D totales
Le tableau 17 donne un aperçu des recettes tirées des ventes et des dépenses de R-D déclarées au cours de la période de 1988 à 2015.
La valeur des recettes totales déclarées par les brevetés a totalisé 19,7 milliards de dollars en 2015, ce qui représente une augmentation de 6,7 % par rapport à 2014. Les recettes tirées des ventes déclarées par les brevetés membres de Médicaments novateurs Canada ont totalisé 15,6 milliards de dollars, soit 79,1 % de l’ensemble des recettes. (De ce montant, moins de 1 % des recettes découlent d’ententes de vente sous licence.)
Les dépenses de R-D déclarées par les brevetés ont totalisé 869,1 millions de dollars en 2015, ce qui représente un recul de 9,7 % par rapport à 2014. Les dépenses de R-D déclarées par les brevetés membres de Médicaments novateurs Canada ont totalisé 767,4 millions de dollars en 2015, soit une hausse 7,8 % par rapport à l’année précédente. Les brevetés membres de Médicaments novateurs Canada ont effectué 88,3 % de toutes les dépenses de R-D déclarées pour 2015.
Ratios des dépenses de R-D par rapport aux recettes tirées des ventes
Le tableau 17 et la figure 20 présentent également les ratios des dépenses de R-D par rapport aux recettes tirées des ventes. Il convient de noter que, dans ce contexte, en contrepartie de l’adoption des modifications apportées à la Loi en 1987, Médicaments novateurs Canada s’était engagé publiquement à augmenter les dépenses annuelles de R-D de ses membres pour qu’elles totalisent en 1996 10 % des recettes tirées des ventesNote de bas de page 32. Ce niveau de dépenses de R-D a été atteint en 1993, le taux ayant même dépassé 10 % certaines années.
Figure 20. Ratio des dépenses de R-D par rapport aux recettes tirées des ventes chez les brevetés de produits pharmaceutiques, 1988-2015
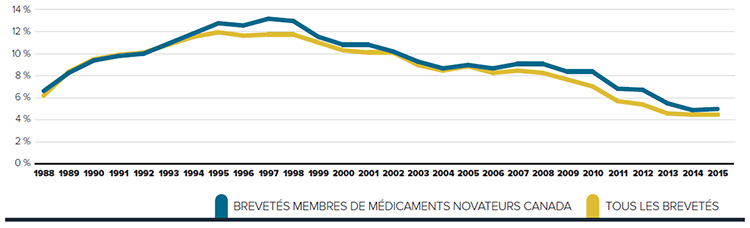
Description de la figure
Il s’agit d’un diagramme linéaire comparant le ratio des dépenses de R-D par rapport aux recettes tirées des ventes parmi tous les brevetés et les brevetés membres de Médicaments novateurs Canada, compte tenu des données recueillies entre 1998 et 2015.
Brevetés membres de Médicaments novateurs Canada: 1988, 6,5; 1989, 8,1; 1990, 9,2; 1991, 9,6; 1992, 9,8; 1993, 10,7; 1994, 11,6; 1995, 12,5; 1996, 12,3; 1997, 12,9; 1998, 12,7; 1999, 11,3; 2000, 10,6; 2001, 10,6; 2002, 10; 2003, 9,1; 2004, 8,5; 2005, 8,8; 2006, 8,5; 2007, 8,9; 2008, 8,9; 2009, 8,2; 2010, 8,2; 2011, 6,7; 2012, 6,3; 2013, 5,1; 2014, 4,8; 2015, 4,9.
Tous les brevetés : 1988, 6,1; 1989, 8,2; 1990, 9,3; 1991, 9,7; 1992, 9,9; 1993, 10,6; 1994, 11,3; 1995, 11,7; 1996, 11,4; 1997, 11,5; 1998, 11,5; 1999, 10,8; 2000, 10,1; 2001, 9,9; 2002, 9,9; 2003, 8,8; 2004, 8,3; 2005, 8,7; 2006, 8,1; 2007, 8,3; 2008, 8,1; 2009, 7,5; 2010, 6,9; 2011, 5,6; 2012, 5,2; 2013, 4,4; 2014, 4,3; 2015, 4,4.
Le ratio de 2015 des dépenses de R-D par rapport aux recettes tirées des ventes parmi les brevetés était de 4,4 %, une légère augmentation par rapport au ratio de 4,3 % en 2014. Le ratio global des dépenses de R-D par rapport aux recettes tirées des ventes a été inférieur à 10 % pendant les 15 dernières années consécutives.
Le ratio correspondant des dépenses de R-D par rapport aux recettes tirées des ventes des brevetés membres de Médicaments novateurs Canada était de 4,9 % en 2015, une légère augmentation par rapport au ratio de 4,8 % en 2014Note de bas de page 33. Le ratio des brevetés membres de Médicaments novateurs Canada a été inférieur à 10 % pendant les 13 dernières années consécutives.
Le tableau 22 à l’Annexe 3 présente en détail la fourchette des ratios des dépenses de R-D par rapport aux recettes tirées des ventes de 2015. Des 77 sociétés ayant présenté des rapports en 2015, 90,9 % ont présenté un ratio de R-D par rapport aux recettes tirées des ventes de moins de 10 %.
Tableau 17. Dépenses totales de R-D et ratios des dépenses de R-D par rapport aux recettes tirées des ventes des sociétés faisant rapport, 1988-2015
| Année |
Tous les brevetés |
Médicaments novateurs Canada |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes : Tous les brevetés (%) |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes : Brevetés membres de Médicaments novateurs Canada (%) |
| Nbre de brevetés |
Dépenses de R-D de tous les brevetés
(millions $) |
Variation par rapport à l’année précédente (%) |
Recettes tirées des ventes
(millions $) |
Variation par rapport à l’année précédente (%) |
Dépenses de R-D de tous les brevetés membres de Médicaments novateurs Canada
(millions $) |
Variation par rapport à l’année précédente (%) |
Recettes tirées des ventes des brevetés membres de Médicaments novateurs Canada
(millions $) |
Variation par rapport à l’année précédente (%) |
| Source : CEPMB |
| 2015 |
77 |
869,1 |
9,7 |
19 693,3 |
6,7 |
767,4 |
7,8 |
15 565,1 |
4,7 |
4,4 |
4,9 |
| 2014 |
75 |
792,2 |
-0,8 |
18 455,1 |
1,0 |
711,7 |
2,0 |
14 861,1 |
9,2 |
4,3 |
4,8 |
| 2013 |
81 |
798,3 |
-14,7 |
18 268,1 |
1,4 |
697,5 |
-15,4 |
13 614,8 |
3,4 |
4,4 |
5,1 |
| 2012 |
85 |
936,1 |
-5,6 |
18 021,1 |
1,3 |
824,1 |
-8,6 |
13 162,8 |
-2,1 |
5,2 |
6,3 |
| 2011 |
79 |
991,7 |
-15,8 |
17 798,8 |
4,7 |
901,2 |
-9,9 |
13 446,1 |
10,7 |
5,6 |
6,7 |
| 2010 |
82 |
1 178,2 |
-7,4 |
17 000,0 |
-0,3 |
1,000,2 |
-11,7 |
12 149,0 |
-11,8 |
6,9 |
8,2 |
| 2009 |
81 |
1 272,0 |
-2,9 |
17 051,9 |
4,5 |
1 132,9 |
-3,4 |
13 780,0 |
4,6 |
7,5 |
8,2 |
| 2008 |
82 |
1 310,7 |
-1,1 |
16 316,7 |
2,0 |
1 172,2 |
-1,0 |
13 178,2 |
-1,4 |
8,1 |
8,9 |
| 2007 |
82 |
1 325,0 |
9,5 |
15 991,0 |
7,3 |
1 184,4 |
24,8 |
13 359,8 |
20,0 |
8,3 |
8,9 |
| 2006 |
72 |
1 210,0 |
-1,9 |
14 902,0 |
4,7 |
949,0 |
-8,8 |
11 131,2 |
-5,8 |
8,1 |
8,5 |
| 2005 |
80 |
1 234,3 |
5,5 |
14 231,3 |
0,5 |
1 040,1 |
3,9 |
11 821,4 |
0,0 |
8,7 |
8,8 |
| 2004 |
84 |
1 170,0 |
-2,0 |
14 168,3 |
4,0 |
1 000,8 |
0,8 |
11 819,0 |
8,8 |
8,3 |
8,5 |
| 2003 |
83 |
1 194,3 |
-0,4 |
13 631,1 |
12,8 |
992,9 |
-3,6 |
10 865,7 |
5,2 |
8,8 |
9,1 |
| 2002 |
79 |
1 198,7 |
13,0 |
12 081,2 |
12,5 |
1 029,6 |
10,1 |
10 323,8 |
16,8 |
9,9 |
10,0 |
| 2001 |
74 |
1 060,1 |
12,6 |
10 732,1 |
15,3 |
935,2 |
14,7 |
8 835,4 |
14,3 |
9,9 |
10,6 |
| 2000 |
79 |
941,8 |
5,3 |
9 ,309,6 |
12,0 |
815,5 |
4,0 |
7 728,8 |
11,6 |
10,1 |
10,6 |
| 1999 |
78 |
894,6 |
12,0 |
8 315,5 |
19,2 |
784,3 |
9,9 |
6 923,4 |
22,8 |
10,8 |
11,3 |
| 1998 |
74 |
798,9 |
10,2 |
6 975,2 |
10,9 |
713,7 |
8,6 |
5 640,2 |
10,6 |
11,5 |
12,7 |
| 1997 |
75 |
725,1 |
9,0 |
6 288,4 |
7,4 |
657,4 |
10,3 |
5 098,2 |
4,9 |
11,5 |
12,9 |
| 1996 |
72 |
665,3 |
6,4 |
5 857,4 |
9,9 |
595,8 |
6,5 |
4 859,5 |
8,7 |
11,4 |
12,3 |
| 1995 |
71 |
625,5 |
11,5 |
5 330,2 |
7,5 |
559,5 |
9,8 |
4 468,8 |
1,4 |
11,7 |
12,5 |
| 1994 |
73 |
561,1 |
11,4 |
4 957,4 |
4,4 |
509,5 |
10,4 |
4 407,2 |
2,0 |
11,3 |
11,6 |
| 1993 |
70 |
503,5 |
22,1 |
4 747,6 |
14,0 |
461,4 |
24,0 |
4 321,4 |
14,4 |
10,6 |
10,7 |
| 1992 |
71 |
412,4 |
9,6 |
4 164,4 |
6,9 |
372,1 |
9,0 |
3 778,4 |
6,5 |
9,9 |
9,8 |
| 1991 |
65 |
376,4 |
23,2 |
3 894,8 |
18,1 |
341,4 |
24,7 |
3 546,9 |
19,5 |
9,7 |
9,6 |
| 1990 |
65 |
305,5 |
24,8 |
3 298,8 |
11,0 |
273,8 |
25,8 |
2 967,9 |
10,5 |
9,3 |
9,2 |
| 1989 |
66 |
244,8 |
47,4 |
2 973,0 |
9,4 |
217,6 |
34,7 |
2 685,5 |
7,3 |
8,2 |
8,1 |
| 1988 |
66 |
165,7 |
— |
2 718,0 |
— |
161,5 |
— |
2 502,3 |
— |
6,1 |
6,5 |
Dépenses courantes selon le type de recherche
Le tableau 18 et la figure 21 (ainsi que la figure 23 à l’Annexe 3) présentent des données sur la ventilation des dépensesNote de bas de page 34 courantes de R-D engagées en 2015 selon le type de recherche, à savoir la recherche fondamentale, la recherche appliquée et autres types de R-D admissiblesNote de bas de page 35. Pour 2015, les brevetés ont fait état de dépenses de recherche fondamentale totalisant 102,2 millions de dollars ou 12,9 % du total des dépenses courantes de R-D, soit une hausse de 24,9 % par rapport à l’année antérieure. Les brevetés ont déclaré des dépenses de recherche appliquée totalisant 456,2 millions de dollars, ou, encore, 57,7 % des dépenses courantes de R-D. Les essais cliniques ont accaparé 72,6 % des dépenses de recherche appliquée.
Tableau 18. Dépenses courantes de R-D selon le type de recherche, 2015 et 2014
| Type de recherche |
Dépenses en 2015
(en M$) |
Part en 2015
(en %) |
Dépenses en 2014
(en M$) |
Part en 2014
(en %) |
Variation annuelle des dépenses
(en %) |
| Recherche fondamentale |
102,2 |
12,9 |
81,8 |
10,7 |
24,9 |
| Chimique |
66,4 |
8,4 |
52,6 |
6,9 |
26,2 |
| Biologique |
35,8 |
4,5 |
29,2 |
3,8 |
22,6 |
| Recherche appliquée |
456,2 |
57,7 |
467,4 |
60,9 |
-2,4 |
| Processus de fabrication |
58,0 |
7,3 |
51,4 |
6,7 |
12,8 |
| Essais précliniques I |
40,4 |
5,1 |
48,9 |
6,4 |
-17,4 |
| Essais précliniques II |
26,7 |
3,4 |
38,0 |
5,0 |
-29,7 |
| Essais cliniques de phase I |
25,1 |
3,2 |
25,4 |
3,3 |
-1,2 |
| Essais cliniques de phase II |
67,1 |
8,5 |
63,4 |
8,3 |
5,8 |
| Essais cliniques de phase III |
238,9 |
30,2 |
240,3 |
31,3 |
-0,6 |
| Autre R-D admissible |
231,7 |
29,3 |
217,8 |
28,4 |
6,4 |
| Total† |
790,1 |
100,0 |
767,1 |
100,0 |
3,0 |
† Il se peut que les valeurs dans cette ligne ne totalisent pas en raison de l’arrondissement.
Source : CEPMB
Figure 21. Dépenses courantes de R-D (%) selon le type de recherche, 1988-2015
Description de la figure
Il s’agit d’un diagramme à colonnes empilées présentant les dépenses courantes de R-D par type de recherche, selon les données recueillies de 1998 à 2015. En 1998, la recherche fondamentale comptait pour 19,1 % des dépenses de R-D, la recherche appliquée, pour 67,2 %, et les travaux regroupés dans la catégorie autre R-D admissible, pour 13,7 %.
- 1989 : fondamentale 23,4, appliquée 62,7, autre R-D admissible 13,9;
- 1990 : fondamentale 27,2, appliquée 58,0, autre R-D admissible 14,8;
- 1991 : fondamentale 26,5, appliquée 57,3, autre R-D admissible 16,2;
- 1992 : fondamentale 26,4, appliquée 57,1, autre R-D admissible 16,5;
- 1993 : fondamentale 25,3, appliquée 60,3, autre R-D admissible 14,4;
- 1994 : fondamentale 21,9, appliquée 62,7, autre R-D admissible 15,4;
- 1995 : fondamentale 22,1, appliquée 61,8, autre R-D admissible 16,1;
- 1996 : fondamentale 21,7, appliquée 62,9, autre R-D admissible 15,4;
- 1997 : fondamentale 20,7, appliquée 62,0, autre R-D admissible 17,3;
- 1998 : fondamentale 19,6, appliquée 61,1, autre R-D admissible 19,4;
- 1999 : fondamentale 18,4, appliquée 63,3, autre R-D admissible 18,3;
- 2000 : fondamentale 17,8, appliquée 61,3, autre R-D admissible 20,9;
- 2001 : fondamentale 16,1, appliquée 59,9, autre R-D admissible 24,0;
- 2002 : fondamentale 17,4, appliquée 55,8, autre R-D admissible 26,6;
- 2003 : fondamentale 15,8, appliquée 55,2, autre R-D admissible 29,1;
- 2004 : fondamentale 19,7, appliquée 58,3, autre R-D admissible 21,7;
- 2005 : fondamentale 18,2, appliquée 62,4, autre R-D admissible 19,5;
- 2006 : fondamentale 20,0, appliquée 59,5, autre R-D admissible 20,5;
- 2007 : fondamentale 20,3, appliquée 54,4, autre R-D admissible 25,6;
- 2008 : fondamentale 15,9, appliquée 57,3, autre R-D admissible 26,8;
- 2009 : fondamentale 19,4, appliquée 56,2, autre R-D admissible 24,3;
- 2010 : fondamentale 21,1, appliquée 54,8, autre R-D admissible 24,2;
- 2011 : fondamentale 17,3, appliquée 55,0, autre R-D admissible 27,8;
- 2012 : fondamentale 12,6, appliquée 57,9, autre R-D admissible 29,4;
- 2013 : fondamentale 8,7, appliquée 63,5, autre R-D admissible 27,8;
- 2014 : fondamentale 10,7 appliquée 60,9, autre R-D admissible 28,4;
- 2015 : fondamentale 12,9 appliquée 57,7, autre R-D admissible 29,3
Dépenses courantes de R-D selon le milieu de recherche
Les brevetés peuvent inclure dans leurs dépenses de R-D la recherche qu’ils effectuent eux-mêmes à l’interne ainsi que la recherche qu’ils font faire à l’externe, notamment par des universités, des hôpitaux et d’autres fabricants. Le tableau 19 révèle que, en 2015, 49,4 % des dépenses courantes de recherche ont été effectuées à l’interne. La proportion de la R-D effectuée par d’autres sociétés pour le compte des brevetés a représenté 21,6 % de l’ensemble des dépenses courantes. Quant à la recherche effectuée par les universités et par les hôpitaux, sa valeur a représenté 17,0 % des dépenses courantes.
Tableau 19. Dépenses courantes de R-D selon le milieu de recherche, 2015 et 2014
| Milieu de recherche |
Dépenses en 2015
(en M$) |
Part en 2015
(en %) |
Dépenses en 2014
(en M$) |
Part en 2014
(en %) |
Variation annuelle des dépenses
(en %) |
† Il se peut que les valeurs dans cette ligne ne totalisent pas en raison de l’arrondissement.
Source : CEPMB |
| À l’interne |
| Patentees |
390,0 |
49,4 |
371,8 |
48,5 |
4,9 |
| À l’externe |
| Universités et hôpitaux |
134,6 |
17,0 |
117,6 |
15,3 |
14,5 |
| Autres sociétés |
170,3 |
21,6 |
190,6 |
24,9 |
-10,7 |
| Autres |
95,2 |
12,1 |
87,1 |
11,3 |
9,4 |
| Total † |
790,1 |
100,0 |
767,1 |
100,0 |
3,0 |
Dépenses courantes de R-D selon la provenance des fonds
Le tableau 20 présente des renseignements sur la provenance des fonds que les brevetés ont investis pour financer leurs activités de R-D. En 2015, les brevetés ont financé à même leurs propres fonds la majeure partie de leur R-D (91,1 % des dépenses courantes). Les fonds provenant du gouvernement ont servi à financer 1,0 % des dépenses courantes.
Tableau 20. Ensemble des dépenses de R-D selon la provenance des fonds, 2015 et 2014
| Provenance des fonds |
Dépenses en 2015
(en M$) |
Part en 2015
(en %) |
Dépenses en 2014
(en m$) |
Part en 2014
(en %) |
Variation annuelle des dépenses
(en %) |
| Brevetés |
791,7 |
91,1 |
703,0 |
88,7 |
12,6 |
| Gouvernements fédéral et provinciaux |
8,3 |
1,0 |
9,8 |
1,2 |
-14,6 |
| Autres |
69,1 |
8,0 |
79,5 |
10,0 |
-13,1 |
| Total† |
869,1 |
100,0 |
792,2 |
100,0 |
9,7 |
† Il se peut que les valeurs dans cette ligne ne totalisent pas en raison de l’arrondissement.
Source : CEPMB
Dépenses courantes de r-d selon la région géographique
Le tableau 21 (ainsi que le tableau 24 et le tableau 25 de l’Annexe 3) ventile les dépenses courantes de R-D selon la région géographique dans laquelle elles ont été engagées. Cette année encore, les dépenses ont été surtout engagées en Ontario et au Québec, qui ont accaparé 81,0 % de la valeur totale des dépenses courantes de R-D. La valeur des dépenses courantes de R-D a augmenté d’un taux annuel de 14,6 % dans l’Ouest du pays, mais elle n’a augmenté que de 6,2 % en Ontario et a diminué de 5,7 % au Québec.
Tableau 21. Dépenses courantes de R-D selon la région géographique, 2015 et 2014
| Région |
Dépenses en 2015
(en M$) |
Part en 2015
(en %) |
Dépenses en 2014
(en M$) |
Part en 2014
(en %) |
Variation annuelle des dépenses
(en %) |
| Provinces de l’Atlantique |
14,3 |
1,8 |
19,0 |
2,5 |
-24,9 |
| Québec |
227,1 |
28,7 |
240,7 |
31,4 |
-5,7 |
| Ontario |
413,0 |
52,3 |
388,8 |
50,7 |
6,2 |
| Provinces de l’Ouest |
135,7 |
17,2 |
118,5 |
15,4 |
14,6 |
| Territoires |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
| Total† |
790,1 |
100,0 |
767,1 |
100,0 |
3,0 |
† Il se peut que les valeurs dans cette ligne ne totalisent pas en raison de l’arrondissement.
Source : CEPMB
Contexte mondial
La figure 22 compare pour les années 2000 et 2013 les ratios des dépenses de R-D pharmaceutiques par rapport aux recettes tirées des ventes du Canada aux mêmes ratios des sept pays de comparaison du CEPMBNote de bas de page 36. Le ratio du Canada était de 10,1 % en 2000. Cette année-là, seule l’Italie présentait un ratio plus bas (6,2 %), tandis que la Suisse présentait le ratio le plus élevé (102,5 %).
En 2013, le Canada présentait le ratio le moins élevé (5,4 %) suivi de l’Italie (5,8 %). Le ratio de tous les autres pays de comparaison est demeuré bien supérieur à celui du Canada. Le ratio obtenu avec l’ensemble des dépenses de R-D et des ventes de tous les pays de comparaison était de 22,8 %, soit plus de cinq fois celui du Canada.
Figure 22. Ratios des dépenses de R-D par rapport aux recettes tirées des ventes, au Canada et dans les pays de comparaison
Source : CEPMB; Fédération européenne des associations de l’industrie pharmaceutique (EFPIA): The Pharmaceutical Industry in Figures 2015 PhRMA 2015 profile
Description de la figure
Il s’agit d’un diagramme à barres présentant les ratios des dépenses de R-D par rapport aux recettes tirées des ventes, au Canada et dans les pays de comparaison, en 2000 et en 2013.
2000 : Canada, 10,1; tous les pays de comparaison, 20,4; France, 16,8; Allemagne, 17,3; Italie, 6,2; Suède, 44,4; Suisse, 102,5; Royaume-Uni, 35,1; États-Unis, 18,4
2013 : Canada, 4,4; tous les pays de comparaison, 22,8; France, 17,9; Allemagne, 22,5; Italie, 5,8; Suède, 21,9; Suisse, 122,4; R.-U., 28,8; É.-U., 22,7
On peut comparer les ratios des dépenses de R-D par rapport aux recettes tirées des ventes présentés à la figure 22 avec les ratios des prix moyens bilatéraux mentionnés au tableau 11 (voir la section « Comparaison des prix pratiqués au Canada avec ceux pratiqués à l’étranger »). Plusieurs pays de comparaison, dont les prix des produits médicamenteux brevetés sont, en moyenne, beaucoup moins élevés qu’au Canada, ont obtenu des ratios des dépenses de R-D par rapport aux recettes tirées des ventes bien supérieurs à ceux au Canada.
Tel que mentionné dans les rapports d’années précédentes, la région géographique où se produit la R-D pharmaceutique dépend de plusieurs facteurs. Parmi les facteurs dont tiennent compte les entreprises, mentionnons notamment la présence, la qualité et la rentabilité des meilleures institutions scientifiques et l’accès aisé à une infrastructure de haute qualité pour les essais cliniques. Bien qu’on cite souvent les niveaux de prix comme importants leviers politiques pour attirer la R-D, les données n’appuient pas une telle corrélation au niveau national ou international.
Annexe 1: Glossaire
Pour de plus amples explications et définitions, veuillez consulter la Loi sur les brevets, le Règlement sur les médicaments brevetés, le Compendium des politiques, des Lignes directrices et des procédures du CEPMB et le Règlement sur les aliments et drogues ou, encore, communiquer avec le CEPMB.
ATC :
Système de classification anatomique, thérapeutique, chimique (ATC) conçu et tenu à jour par le Centre collaborateur de l’OMS pour la méthodologie sur l’établissement des statistiques concernant les produits médicamenteux de l’Organisation mondiale de la Santé (OMS). Ce système distingue les médicaments selon leur site d’action et leurs caractéristiques thérapeutiques et chimiques. Le CEPMB utilise ce système pour sélectionner les médicaments qui seront utilisés dans les comparaisons des prix.
Avis de conformité :
Avis donné en vertu de l’article C.08.004.01 ou C.08.004.01 du Règlement sur les aliments et drogues. Cet avis confirme que le produit médicamenteux respecte les normes prescrites par Santé Canada pour une administration à des humains ou à des animaux, selon le cas, et que sa vente est autorisée au Canada.
Brevet :
Instrument émis par le Commissaire aux brevets sous forme de lettres patentes. Le brevet confère à son titulaire un monopole d’une durée limitée pour les allégations formulées. Le brevet confère également à son titulaire et à ses représentants légaux le droit exclusif de fabriquer, de construire, d’exploiter ou de vendre son invention.
Brevet en instance :
Demande pour un brevet qui n’a pas encore été attribué.
Breveté :
Aux termes du paragraphe 79(1) de la Loi sur les brevets, le mot « breveté » désigne « la personne ayant droit aux retombées d’un brevet pour une invention liée à un médicament, ainsi que quiconque était titulaire d’un brevet pour une telle invention ou qui exerce ou a exercé les droits d’un titulaire dans un cadre autre qu’une licence prorogée en vertu du paragraphe 11(1) de la Loi de 1992 modifiant la Loi sur les brevets ».
CEPMB7 :
La France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis.
Certificat de décision préalable :
Certificat non contraignant délivré à la demande du breveté en vertu du paragraphe 98(4) de la Loi sur les brevets lorsque le Conseil estime que le prix pratiqué ou proposé du produit médicamenteux ne dépasse pas le prix maximal non excessif qu’autorisent ses Lignes directrices.
Cession de brevet :
Avis donné par le breveté au Commissaire aux brevets l’informant qu’il renonce irrévocablement à ses droits de propriété à l’égard du brevet en cause et qu’il les cède au domaine public. Note : Depuis le 30 janvier 1995, le Conseil ne reconnaît pas la cession d’un brevet lorsque le breveté utilise cette mesure pour se soustraire à sa compétence en matière d’examen du prix.
Défaut de présenter ses rapports :
Défaut complet d’un breveté de déclarer un produit médicamenteux breveté vendu conformément aux exigences réglementaires en matière de présentation de rapport prévues à la Loi sur les brevets et au Règlement sur les médicaments brevetés.
Défaut de soumettre ses rapports :
Défaut partiel ou complet d’un breveté de respecter les exigences réglementaires en matière de soumission de rapport prévues à la Loi sur les brevets et au Règlement sur les médicaments brevetés.
Dépenses courantes de recherche-développement :
Désignent les dépenses autres qu’en capital directement liées à la recherche, dont : (a) salaires; (b) matériel direct; (c) entrepreneurs et sous-traitants; (d) autres coûts directs tels que les frais généraux de production; (e) paiements aux institutions désignées; (f) paiements aux organismes subventionnaires; (g) paiements aux autres organismes. Ces éléments sont décrits plus amplement dans le Formulaire 3 présenté dans le Guide du breveté qui se trouve dans le site Web du CEPMB sous « Rapports réglementaires ».
Dépenses de recherche-développement :
Aux termes du Règlement sur les médicaments brevetés, et plus particulièrement de ses articles 5 et 6, la recherche-développement s’entend des activités qui auraient été considérées admissibles au crédit d’impôt à l’investissement pour la recherche scientifique et le développement expérimental en vertu de la Loi de l’impôt sur le revenu dans sa version du 1er décembre 1987.
Engagement de conformité volontaire :
Engagement écrit pris par le breveté de rajuster le prix de son produit médicamenteux pour le rendre conforme aux Lignes directrices du Conseil. La présidente du Conseil peut, en lieu d’un avis d’audience, accepter un engagement de conformité volontaire si celui-ci sert les meilleurs intérêts du grand public. La politique du Conseil sur la conformité et l’application autorise le breveté à soumettre un engagement de conformité volontaire même si un avis d’audience a été émis. Toutefois, l’engagement soumis à ce point doit être approuvé par le panel d’audience. Le Conseil publie tous les engagements acceptés par la présidente ou le Conseil.
Indice des prix des médicaments brevetés (IPMB) :
Indice établi par le CEPMB pour mesurer la variation annuelle des prix de transaction des médicaments brevetés vendus au Canada. Cet indice est établi à partir des données sur les prix et sur les ventes déclarées par les brevetés.
Licence volontaire :
Engagement contractuel entre un breveté et un titulaire de licence permettant à ce dernier de bénéficier des retombées d’un brevet ou d’exercer des droits à l’égard de celui-ci moyennant une contrepartie financière (comme des redevances sous forme de pourcentage des recettes tirées des ventes).
Médicament :
Toute substance ou tout mélange de substances produites biologiquement, chimiquement ou autrement qui est appliqué ou administré in vivo pour faciliter le diagnostic, le traitement, l’atténuation ou la prévention d’une maladie, de symptômes, de troubles ou d’états physiques anormaux ou, encore, pour modifier des fonctions organiques chez les humains ou chez les animaux. Cette définition comprend les vaccins, les préparations topiques, les anesthésiques et les produits de diagnostic in vivo quel que soit le mode d’administration (p. ex. préparations transdermiques, gélules, solutions injectables, solutions pour inhalation, etc.). Cette définition exclut les appareils médicaux, les produits de diagnostic in vitro et les désinfectants qui ne sont pas utilisés in vivo.
Numéro d’identification du médicament (DIN) :
Numéro d’identification que la Direction générale des produits de santé et des aliments de Santé Canada attribue à chaque produit médicamenteux vendu sous ordonnance ou en vente libre et commercialisé en vertu du Règlement sur les aliments et drogues. Le DIN est assigné en tenant compte des éléments suivants : le fabricant du produit, le ou les ingrédients actifs, la concentration du ou des ingrédients actifs, la forme posologique, le nom de marque du produit et son mode d’administration.
Produit générique :
Produit médicamenteux contenant le même ingrédient actif, la même concentration et la même forme posologique que son équivalent de marque.
Produit médicamenteux :
Présentation d’un médicament qui se distingue par sa forme pharmaceutique et la concentration de son ingrédient actif.
Programme d’accès spécial :
Programme en vertu duquel Santé Canada permet à des praticiens d’avoir accès à des produits médicamenteux n’ayant pas encore été approuvés ou qui ne seraient autrement pas disponibles sur le marché canadien.
Recherche et développement (R-D) :
Recherche fondamentale ou appliquée visant à créer de nouveaux matériaux, dispositifs, produits ou procédés ou à améliorer ceux qui existent (p. ex. procédés de fabrication).
Recherche et développement — autre R-D Admissible :
Comprend les dépenses de recherche-développement admissibles qui ne correspondent à aucune des catégories de R-D susmentionnées. Elle comprend les présentations sur la réglementation des produits médicamenteux, les études de biodisponibilité ainsi que les essais cliniques de phase IV.
Recherche et développement — recherche appliquée :
Activité de recherche et développement entreprise avec une application pratique précise en vue, notamment la recherche visant à améliorer les procédés de fabrication ainsi que les études précliniques et cliniques.
Substance active :
Substance chimique ou biologique responsable de l’effet pharmacologique d’un produit médicamenteux.
Annexe 2 : Produits médicamenteaux brevetés ayant fait l’objet d’un premier rapport au CEPMB en 2015
blank
|
Marque de commerce |
Société |
DIN |
Statut |
Niveau d’amélioration thérapeutique/catégorie* |
| 1 |
ASMANEX TWISTHALER - 100 mcg/dose |
Merck Canada Inc. |
02438690 |
Sous enquête |
MN |
| 2 |
BREO ELLIPTA 200/25 |
GlaxoSmithKline Inc. |
02444186 |
Sous examen |
|
| 3 |
COMBIVENT RESPIMAT - 20/100 |
Boehringer Ingelheim (Canada) Ltd. |
02419106 |
Conforme aux lignes directrices |
MN |
| 4 |
COSENTYX - 150 mg/mL |
Novartis Pharma Canada Inc. |
02438070 |
Conforme aux lignes directrices |
MN |
| 5 |
CYRAMZA - 10 mg/mL |
Eli Lilly Canada Inc. |
02443805 |
Sous examen |
|
| 6 |
CYSVIEW - 100 mg/fiole |
BioSyent Pharma Inc. |
02436639 |
Conforme aux lignes directrices |
AM-P |
| 7 |
DAKLINZA - 30 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02444747 |
Conforme aux lignes directrices |
MN |
| 8 |
DAKLINZA - 60 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02444755 |
Conforme aux lignes directrices |
MN |
| 9 |
DUAKLIR GENUAIR - 412 mcg/dose |
AstraZeneca Canada Inc. |
02439530 |
Ne justifie pas une enquête |
MN |
| 10 |
DYMISTA 137/50 |
MEDA Pharmaceuticals Ltd. |
02432889 |
Sous examen |
|
| 11 |
EGRIFTA - 1 mg/fiole |
Theratechnologies Inc. |
02438712 |
Sous examen |
|
| 12 |
ELLA - 30 mg/comprimé |
Allergan Inc. |
02436329 |
Sous enquête |
MN |
| 13 |
ENTRESTO 24,3/25,7 |
Novartis Pharma Canada Inc. |
02446928 |
Conforme aux lignes directrices |
AI |
| 14 |
ENTRESTO 48,6/51,4 |
Novartis Pharma Canada Inc. |
02446936 |
Conforme aux lignes directrices |
AI |
| 15 |
ENTRESTO 97,2/102,8 |
Novartis Pharma Canada Inc. |
02446944 |
Conforme aux lignes directrices |
AI |
| 16 |
ENTYVIO - 300 mg/fiole |
Takeda Canada Inc. |
02436841 |
Conforme aux lignes directrices |
MN |
| 17 |
EXELON PATCH 15 - 27 mg/timbre |
Novartis Pharma Canada Inc. |
02432803 |
Conforme aux lignes directrices |
MN |
| 18 |
FETZIMA - 20 mg/gélule |
Actavis Speciality Pharmaceuticals Co. |
02440970 |
Conforme aux lignes directrices |
MN |
| 19 |
FETZIMA - 40 mg/gélule |
Actavis Speciality Pharmaceuticals Co. |
02440989 |
Conforme aux lignes directrices |
MN |
| 20 |
FLUAD PEDIATRIC - 22,5 mcg/dose |
Novartis Pharma Canada Inc. |
02434881 |
Sous enquête |
MN |
| 21 |
FLULAVAL TETRA - 15 unités/dose |
GlaxoSmithKline Inc. |
02420783 |
Conforme aux lignes directrices |
MN |
| 22 |
FORXIGA - 10 mg/comprimé |
AstraZeneca Canada Inc. |
02435470 |
Conforme aux lignes directrices |
MN |
| 23 |
FORXIGA - 5 mg/comprimé |
AstraZeneca Canada Inc. |
02435462 |
Ne justifie pas une enquête |
MN |
| 24 |
FUMAGILLINE - 20 mg/gélule |
sanofi-aventis Canada Inc. |
|
Conforme aux lignes directrices |
D |
| 25 |
GARDASIL 9 |
Merck Canada Inc. |
02437058 |
Sous enquête |
AM-P |
| 26 |
HOLKIRA PAK 12,5/75/50/250 |
Abbvie |
02436027 |
Conforme aux lignes directrices |
MN |
| 27 |
HUMALOG KWIKPEN - 200 unités/mL |
Eli Lilly Canada Inc. |
02439611 |
Conforme aux lignes directrices |
MN |
| 28 |
ICLUSIG - 15 mg/comprimé |
Paladin Labs Inc. |
02437333 |
Conforme aux lignes directrices |
AM-P |
| 29 |
INCRUSE ELLIPTA - 62,5 mcg/dose |
GlaxoSmithKline Inc. |
02423596 |
Conforme aux lignes directrices |
MN |
| 30 |
INSPIOLTO RESPIMAT 2,5/2,5 |
Boehringer Ingelheim (Canada) Ltd. |
02441888 |
Conforme aux lignes directrices |
MN |
| 31 |
JAKAVI - 10 mg/comprimé |
Novartis Pharma Canada Inc. |
02434814 |
Conforme aux lignes directrices |
MN |
| 32 |
JANUMET XR 100/1000 |
Merck Canada Inc. |
02436808 |
Conforme aux lignes directrices |
MN |
| 33 |
JANUMET XR 50/500 |
Merck Canada Inc. |
02416786 |
Conforme aux lignes directrices |
3 |
| 34 |
JARDIANCE - 10 mg/comprimé |
Boehringer Ingelheim (Canada) Ltd. |
02443937 |
Sous examen |
|
| 35 |
JARDIANCE - 25 mg/comprimé |
Boehringer Ingelheim (Canada) Ltd. |
02443945 |
Sous examen |
|
| 36 |
JINARC |
Otsuka Canada Pharmaceutical Inc. |
02437503 |
Ne justifie pas une enquête |
MN |
| 37 |
JINARC |
Otsuka Canada Pharmaceutical Inc. |
02437511 |
Ne justifie pas une enquête |
MN |
| 38 |
JINARC |
Otsuka Canada Pharmaceutical Inc. |
02437538 |
Ne justifie pas une enquête |
MN |
| 39 |
KALYDECO - 50 mg/emballage |
Vertex Pharmaceuticals Canada Inc. |
02442612 |
Sous examen |
|
| 40 |
KALYDECO - 50 mg/emballage |
Vertex Pharmaceuticals Canada Inc. |
02442620 |
Sous examen |
|
| 41 |
KEYTRUDA - 50 mg/fiole |
Merck Canada Inc. |
02441152 |
Sous examen |
|
| 42 |
KOGENATE FS - 1000 unités/fiole |
Bayer Inc. |
02291533 |
Sous examen |
|
| 43 |
KOGENATE FS - 2000 unités/fiole |
Bayer Inc. |
02302217 |
Sous examen |
|
| 44 |
KOGENATE FS - 250 unités/fiole |
Bayer Inc. |
02291517 |
Sous examen |
|
| 45 |
KOGENATE FS 3000 unités/fiole |
Bayer Inc. |
02342731 |
Sous examen |
|
| 46 |
KOGENATE FS - 500 unités/fiole |
Bayer Inc. |
02291525 |
Sous examen |
|
| 47 |
LODALIS - 3,75 g/dose |
Valeant Canada LP |
02432463 |
Ne justifie pas une enquête |
MN |
| 48 |
MITOSOL - 0,2 mg/mL |
Laptician Opthalmics Inc. |
|
ECV |
AM-S |
| 49 |
MOVANTIK - 12,5 mg/comprimé |
AstraZeneca Canada Inc. |
02442467 |
Conforme aux lignes directrices |
MN |
| 50 |
MOVANTIK - 25 mg/comprimé |
AstraZeneca Canada Inc. |
02442176 |
Conforme aux lignes directrices |
MN |
| 51 |
NIASTASE RT - 1 mg/fiole |
Novo Nordisk Canada Inc. |
02417103 |
Ne justifie pas une enquête |
MN |
| 52 |
NIASTASE RT - 2 mg/fiole |
Novo Nordisk Canada Inc. |
02417111 |
Ne justifie pas une enquête |
MN |
| 53 |
NIASTASE RT - 5 mg/fiole |
Novo Nordisk Canada Inc. |
02417138 |
Ne justifie pas une enquête |
MN |
| 54 |
OFEV - 100 mg/gélule |
Boehringer Ingelheim (Canada) Ltd. |
02443066 |
Conforme aux lignes directrices |
MN |
| 55 |
OFEV - 150 mg/gélule |
Boehringer Ingelheim (Canada) Ltd. |
02443074 |
Conforme aux lignes directrices |
MN |
| 56 |
PANTOPRAZOLE MAGNESIUM - 40 mg/comprimé |
Aspri Pharma Canada Inc. |
02441853 |
Sous examen |
|
| 57 |
PERGOVERIS - 150 unités/trousse |
EMD Serono Canada Inc. |
02445301 |
Sous enquête |
MN |
| 58 |
PLEGRIDY |
Biogen Idec Canada Inc. |
02444402 |
Sous examen |
|
| 59 |
PLEGRIDY - 125 mcg/seringue |
Biogen Idec Canada Inc. |
02444399 |
Sous examen |
|
| 60 |
PLIAGLIS 70/70 |
Galderma Canada Inc. |
02398028 |
Sous enquête |
MN |
| 61 |
REPATHA - 140 mg/seringue |
Amgen Canada Inc. |
02446057 |
Sous examen |
|
| 62 |
REVESTIVE - 5 mg/fiole |
Shire Canada Inc. |
02445727 |
Sous examen |
|
| 63 |
REVLIMID - 20 mg/gélule |
Celgene Inc. |
02440601 |
Conforme aux lignes directrices |
MN |
| 64 |
ROSIVER - 10 mg/g |
Galderma Canada Inc. |
02440342 |
Conforme aux lignes directrices |
MN |
| 65 |
SAXENDA - 6 mg/mL |
Novo Nordisk Canada Inc. |
02437899 |
Conforme aux lignes directrices |
MN |
| 66 |
SIGNIFOR LAR - 40 mg/fiole |
Novartis Pharma Canada Inc. |
02437260 |
Sous examen |
|
| 67 |
SIGNIFOR LAR - 60 mg/fiole |
Novartis Pharma Canada Inc. |
02437279 |
Sous examen |
|
| 68 |
SIMBRINZA |
Alcon Canada Inc. |
02435411 |
Conforme aux lignes directrices |
MN |
| 69 |
SPIRIVA RESPIMAT - 5 mcg/dose |
Boehringer Ingelheim (Canada) Ltd. |
02435381 |
Sous enquête |
MN |
| 70 |
SYLVANT - 100 mg/fiole |
Janssen Inc. |
02435128 |
Sous examen |
|
| 71 |
SYLVANT - 400 mg/fiole |
Janssen Inc. |
02435136 |
Sous examen |
|
| 72 |
TACHOSIL 2/5 |
Takeda Canada Inc. |
02439026 |
Conforme aux lignes directrices |
MN |
| 73 |
TECHNIVIE 12,5/75/50 |
Abbvie |
02447711 |
Sous examen |
|
| 74 |
TEFLARO - 400 mg/fiole |
Actavis Speciality Pharmaceuticals Co. |
|
Conforme aux lignes directrices |
MN |
| 75 |
TOUJEO SOLOSTAR - 200 unités/mL |
sanofi-aventis Canada Inc. |
02441829 |
Sous examen |
|
| 76 |
TRANSLARNA - 250 mg/sachet |
PTC Therapeutics International Limited |
|
Sous examen |
|
| 77 |
TRULICITY - 1,5 mg/mL |
Eli Lilly Canada Inc. |
02448602 |
Sous examen |
|
| 78 |
TYBOST - 150 mg/comprimé |
Gilead Sciences Inc. |
02411423 |
Ne justifie pas une enquête |
MN |
| 79 |
VITEKTA - 150 mg/comprimé |
Gilead Sciences Inc. |
02411180 |
Conforme aux lignes directrices |
MN |
| 80 |
VITEKTA - 85 mg/comprimé |
Gilead Sciences Inc. |
02411172 |
Conforme aux lignes directrices |
MN |
| 81 |
VYVANSE - 10 mg/gélule |
Shire Canada Inc. |
02439603 |
Sous examen |
|
| 82 |
XARELTO - 15 mg/trousse |
Bayer Inc. |
02441535 |
Sous examen |
|
| 83 |
XTANDI - 40 mg/gélule |
Astellas Pharma Canada Inc. |
02407329 |
Ne justifie pas une enquête |
MN |
| 84 |
ZYDELIG - 100 mg/comprimé |
Gilead Sciences Inc. |
02438798 |
Conforme aux lignes directrices |
MN |
| 85 |
ZYDELIG - 150 mg/comprimé |
Gilead Sciences Inc. |
02438801 |
Conforme aux lignes directrices |
MN |
| 86 |
ZYKADIA - 150 mg/gélule |
Novartis Pharma Canada Inc. |
02436779 |
Conforme aux lignes directrices |
MN |
*Vendus après l’entrée en vigueur des nouvelles Lignes directrices en 2010 :
- MN Amélioration minime ou nulle
- AM-S Amélioration modeste – facteurs secondaires
- AM-P Amélioration modeste – facteurs principaux
- AI Amélioration importante
- D Découverte
Vendu avant l’entrée en vigueur des nouvelles Lignes directrices en 2010 :
Catégorie 1 Une forme posologique existante ou comparable d’un médicament existant.
Catégorie 2 Une forme posologique non comparable d’un médicament existant, ou le premier DIN d’une nouvelle entité chimique constituant une découverte, sinon une amélioration importante par rapport aux DIN existants comparables.
Catégorie 3 Une forme posologique non comparable d’un médicament existant ou le premier DIN d’une nouvelle entité chimique offrant une amélioration modeste, voire même aucune amélioration par rapport aux DIN existants comparables.
Annexe 3 : Recherche et développement
Tableau 22. Intervalle des ratios des dépenses de R-D par rapport aux recettes tirées des ventes selon le nombre de sociétés ayant présenté des rapports et la valeur des recettes totales tirées des ventes
| Intervalle du ratio des dépenses de R-D par rapport aux recettes tirées des ventes |
Nombre de sociétés ayant présenté un rapport en 2015 |
Recettes tirées des ventes en 2015
(en M$)
|
Part en 2015
(en %)
|
Nombre de sociétés ayant présenté un rapport en 2014 |
Recettes tirées des ventes en 2014
(en M$)
|
Part en 2014
(en %)
|
| 0% |
32 |
1 999,9 |
10,2 |
28 |
2 008,8 |
10,9 |
| ≤10% |
38 |
15 767,8 |
80,1 |
39 |
15 604,9 |
84,8 |
| >10% |
7 |
1 925,6 |
9,8 |
8 |
805,4 |
4,4 |
| Total |
77 |
19 693,3 |
100,0† |
75 |
18 455,1 |
100,0† |
† Il se peut que les valeurs de cette colonne ne totalisent pas 100,0 en raison de l’arrondissement.
Source : CEPMB
Figure 23. Dépenses courantes de R-D (en M$) selon le type de recherche, 1988-2015
Description de la figure
Il s’agit d’un diagramme à colonnes empilées présentant les dépenses courantes de R-D, en millions de dollars, par type de recherche, en fonction des données recueillies de 1998 à 2015.
| Année |
Fondamentale |
Appliquée |
Autre R-D admissible |
| 1988 |
30,3 |
106,6 |
21,7 |
| 1989 |
53,5 |
143,1 |
31,8 |
| 1990 |
78,3 |
167,2 |
42,8 |
| 1991 |
94,2 |
203,5 |
57,6 |
| 1992 |
103,7 |
224,1 |
64,9 |
| 1993 |
120,7 |
290,9 |
68,8 |
| 1994 |
117,4 |
336,5 |
80,8 |
| 1995 |
132,0 |
369,3 |
96,5 |
| 1996 |
136,6 |
396,4 |
97,1 |
| 1997 |
140,4 |
421,3 |
117,5 |
| 1998 |
146,8 |
458,0 |
145,3 |
| 1999 |
155,9 |
535,2 |
154,7 |
| 2000 |
159,1 |
547,2 |
187,0 |
| 2001 |
163,1 |
604,8 |
242,6 |
| 2002 |
198,6 |
637,0 |
304,4 |
| 2003 |
180,3 |
631,5 |
332,6 |
| 2004 |
221,7 |
658,3 |
244,2 |
| 2005 |
215,1 |
737,5 |
230,1 |
| 2006 |
232,4 |
689,6 |
237,4 |
| 2007 |
259,0 |
688,2 |
326,8 |
| 2008 |
200,2 |
723,2 |
337,9 |
| 2009 |
237,1 |
685,3 |
296,8 |
| 2010 |
235,9 |
613,4 |
270,8 |
| 2011 |
164,9 |
525,1 |
265,2 |
| 2012 |
114,6 |
525,5 |
266,9 |
| 2013 |
67,6 |
492,2 |
215,0 |
| 2014 |
81,8 |
456,1 |
217,8 |
| 2015 |
102,2 |
456,2 |
231,7 |
Tableau 23. Ratios des dépenses de R-D par rapport aux recettes tirées des ventes selon les brevetés1, 2015 et 2014
| Société |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes
(en %) 2015 |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes
(en %) 2014 |
Ratio du prix international médian par rapport aux prix canadiens (en %) – limite de 5 pays |
| Abbott Laboratories, Ltd. |
0,0 |
0,0 |
44 |
| AbbVie Corporation2,3,4 |
3,0 |
2,2 |
105 |
| Actavis Specialty Pharmaceuticals Co. (Watson Pharma Co.) |
0,0 |
0,1 |
- |
| Actelion Pharmaceuticals Canada Inc.2,4 |
2,6 |
4,2 |
104 |
| Aegerion Pharma Canada Ltd.3 |
0,0 |
1,9 |
- |
| Alcon Canada Inc. |
0,6 |
0,1 |
- |
| Alexion Pharmaceuticals Inc.3 |
0,0 |
0,0 |
- |
| Allergan Inc. |
2,4 |
5,0 |
69 |
| Amgen Canada Inc.2,3 |
5,3 |
6,0 |
88 |
| Aspri Pharma Canada Inc. |
0,0 |
0,0 |
- |
| Astellas Pharma Canada Inc.2,6 |
3,6 |
2,0 |
130 |
| AstraZeneca Canada Inc.2,3 |
4,9 |
3,0 |
76 |
| Baxalta Canada Corp.5 |
0,0 |
- |
- |
| Baxter Corporation |
0,0 |
0,3 |
102 |
| Bayer Inc.2 |
5,5 |
5,2 |
90 |
| BGP Pharma ULC.10 |
0,0 |
- |
- |
| Biogen Idec Canada Inc.3 |
10,8 |
10,2 |
105 |
| BioMarin Canada Inc.3 |
47,0 |
42,5 |
- |
| Biovitrum AB |
0,0 |
0,0 |
- |
| BioSyent Pharma Inc.5 |
0,0 |
- |
- |
| Boehringer Ingelheim (Canada) Ltd.2 |
5,5 |
4,5 |
87 |
| Bracco Diagnostics Canada Inc. |
0,0 |
0,0 |
- |
| Bristol-Myers Squibb Canada2,3 |
10,8 |
9,7 |
118 |
| Celgene Inc.3 |
1,6 |
2,0 |
102 |
| Correvio (UK) Ltd. (Iroko International LP) |
0,0 |
0,0 |
- |
| CSL Behring Canada Inc. |
0,2 |
0,5 |
- |
| Duchesnay Inc. |
14,3 |
12,5 |
- |
| Eisai Limited2,3 |
1,2 |
0,9 |
78 |
| Eli Lilly Canada Inc. (includes Provel Animal Health Division)2,3 |
3,3 |
4,3 |
76 |
| EMD Serono Canada Inc.2 |
0,0 |
5,8 |
- |
| Ferring Pharmaceuticals Inc.2 |
0,0 |
0,0 |
94 |
| Galderma Canada Inc. |
0,0 |
0,0 |
- |
| Gilead Sciences Canada, Inc.2 |
16,2 |
22,6 |
106 |
| GlaxoSmithKline Inc.2 |
5,8 |
8,5 |
68 |
| Grifols Canada Ltd. (Talecris Biotherapeutics Ltd.)3 |
0,0 |
0,0 |
- |
| Hoffmann-La Roche Ltd. Canada,2,3 |
5,1 |
4,9 |
- |
| Horizon Pharma PLC.5 |
0,0 |
- |
- |
| Hospira Healthcare Corp. |
0,0 |
0,0 |
- |
| Ipsen Biopharmaceuticals Canada Inc.3,5 |
0,0 |
- |
- |
| Janssen Inc.2,3 |
3,4 |
3,3 |
- |
| Johnson & Johnson Inc. |
0,0 |
0,0 |
89 |
| Johnson & Johnson Medical Products |
0,0 |
1,7 |
- |
| Lantheus MI Canada Inc. |
0,0 |
0,0 |
- |
| LEO Pharma Inc.2 |
1,6 |
1,2 |
50 |
| Lundbeck Canada Inc.2 |
2,0 |
0,8 |
51 |
| Lupin Pharma Canada Limited5 |
0,4 |
- |
- |
| Mallinckrodt Canada Inc. |
0,0 |
0,0 |
- |
| McNeil Consumer Healthcare Canada |
3,8 |
3,8 |
- |
| Meda Pharmaceuticals Ltd.5 |
0,0 |
- |
30 |
| Merck Canada Inc.2,3 |
2,2 |
2,4 |
70 |
| Merus Labs |
0,0 |
0,0 |
|
| Merz Pharma Canada Ltd. |
1,3 |
5,8 |
- |
| Novartis Pharmaceuticals Canada Inc.2,3 |
3,9 |
6,4 |
86 |
| Novo Nordisk Canada Inc.2,3 |
2,0 |
2,9 |
78 |
| Octapharma Canada Inc.5 |
0,1 |
- |
- |
| Otsuka Canada Pharmaceutical Inc. (OCPI)2 |
4,5 |
48,0 |
104 |
| Paladin Labs Inc.2 |
0,2 |
0,0 |
- |
| Pfizer Canada Inc.2,3 |
0,9 |
1,2 |
83 |
| Purdue Pharma2 |
3,9 |
4,6 |
- |
| PTC Therapeutics International Ltd.5 |
0,0 |
- |
- |
| Ranbaxy Pharmaceuticals Canada Inc. |
0,0 |
0,0 |
- |
| Salix Pharmaceuticals Inc. |
0,0 |
45,9 |
- |
| Sanofi Canada Inc.2,8 |
2,1 |
2,4 |
71 |
| Sanofi Pasteur Ltd.2,3,7 |
80,1 |
67,1 |
- |
| Seattle Genetics Inc. |
7,2 |
5,2 |
- |
| Servier Canada Inc.2 |
2,6 |
4,7 |
|
| Shire Canada Inc.2,3 |
0,0 |
0,2 |
93 |
| Shire Human Genetic Therapies2,3 |
0,0 |
1,6 |
- |
| Sunovion Pharmaceuticals Canada Inc.2 |
0,0 |
0,0 |
- |
| Takeda Canada Inc.2,3 |
0,0 |
0,0 |
40 |
| Theratechnologic Inc.5 |
0,0 |
- |
- |
| Teva Canada Innovation3 |
0,1 |
0,7 |
101 |
| Tribute Pharma Canada Inc. |
0,0 |
0,0 |
25 |
| UCB Canada Inc.3 |
1,0 |
1,7 |
88 |
| Valeant Canada Ltd.3,9 |
5,0 |
0,0 |
143 |
| Vertex Pharma Canada Inc. |
72,5 |
66,5 |
|
| VIIV Healthcare ULC2 |
0,0 |
0,0 |
- |
1 Pour éviter la double comptabilisation des recettes tirées des ventes, les recettes tirées des redevances sont incluses dans le calcul du ratio de chaque société mais non dans le calcul du ratio à l’échelle de l’industrie. Les subventions des gouvernements fédéral et provinciaux ne sont pas comptabilisées dans les dépenses utilisées pour le calcul des ratios des dépenses de R-D de chaque société, mais elles le sont dans les statistiques pour l’ensemble de l’industrie. La liste des sociétés ayant soumis un rapport sur les prix n’est pas identique à celle des sociétés ayant soumis un rapport sur leurs activités de R-D en raison des différences des modalités de rapport entre les brevetés et leurs sociétés affiliées ou les détenteurs d’une licence d’exploitation. Il convient également de noter que certains titulaires d’un brevet pour un médicament vétérinaire (soit les brevetés qui ne tirent aucun revenu de la vente de produits pour un usage humain) sont tenus de présenter un rapport sur leurs dépenses de R-D, mais pas nécessairement sur les prix qu’ils pratiquent et sur la valeur de leurs ventes.
2 Membre de Rx&D.
3 Membre de BIOTECanada.
4 Société détachée de la division des produits de marque déposée d’Abbott en entité juridique distincte depuis le 31 octobre 2012.
5 N’était pas un breveté en 2013.
6 Anciennement connu sous le nom Fujisawa Canada Inc.
7 Anciennement connu sous le nom Aventis Pasteur Ltd.
8 Anciennement connu sous le nom Aventis Pharma Inc.
9 Anciennement connu sous le nom ICN Canada Ltd.
10 « BGP Pharma ULC » hébergera les marques pharmaceutiques antérieurement connues sous les noms « Abbott » et « Fournier » au Canada.
Tableau 24. Dépenses courantes de R-D selon la province ou le territoire, 2015
| Province |
Dépenses par tous les brevetés (000 $) |
Part régionale (%) |
Dépenses par tous les brevetés Médicaments novateurs Canada (000 $) |
Part régionale (%) |
| Terre-Neuve |
2 999,41 |
0,380 |
2 563,02 |
0,371 |
| Île-du-Prince-Édouard |
5,43 |
0,001 |
0,00 |
0,000 |
| Nouvelle-Écosse |
8 455,91 |
1,070 |
7 729,53 |
1,120 |
| Nouveau-Brunswick |
2 793,94 |
0,354 |
2 279,21 |
0,330 |
| Québec |
227 133,63 |
28,747 |
179 680,40 |
26,030 |
| Ontario |
412 975,46 |
52,268 |
375 049,74 |
54,332 |
| Manitoba |
5 918,95 |
0,749 |
4 455,34 |
0,645 |
| Saskatchewan |
2 575,71 |
0,326 |
1 867,80 |
0,271 |
| Alberta |
89 902,36 |
11,379 |
82 351,90 |
11,930 |
| Colombie-Britannique |
37 344,27 |
4,726 |
34 314,02 |
4,971 |
| Territoires |
0 |
0,000 |
0 |
0,000 |
| Canada† |
790 105,07 |
100,0 |
690 290,97 |
100,0 |
† Il se peut que les valeurs de cette ligne ne totalisent pas en raison de l’arrondissement.
Source : CEPMB
Tableau 25. Dépenses courantes de R-D selon le milieu de recherche et la province ou le territoire, 2015
| Province |
blank |
Brevetés |
Autres sociétés |
Université |
Hôpitaux |
Autres |
| Terre-Neuve |
000 $ |
701,33 |
1 247,63 |
512,97 |
263,14 |
274,34 |
| blank |
% |
23,4 |
41,6 |
17,1 |
8,8 |
9,1 |
| Île-du-Prince-Édouard |
000 $ |
0,00 |
0,00 |
5,43 |
0,00 |
0,00 |
| blank |
% |
0,0 |
0,0 |
100,0 |
0,0 |
0,0 |
| Nouvelle-Écosse |
000 $ |
1 190,80 |
3 263,46 |
781,80 |
2 096,15 |
1 123,69 |
| blank |
% |
14,1 |
38,6 |
9,2 |
24,8 |
13,3 |
| Nouveau-Brunswick |
000 $ |
395,16 |
1 012,86 |
486,14 |
560,46 |
339,32 |
| blank |
% |
14,1 |
36,3 |
17,4 |
20,1 |
12,1 |
| Québec |
000 $ |
86 732,19 |
70 362,09 |
12 955,95 |
15 892,56 |
41 190,84 |
| blank |
% |
38,2 |
31,0 |
5,7 |
7,0 |
18,1 |
| Ontario |
000 $ |
218 209,52 |
73 581,32 |
37 683,76 |
46 040,23 |
37 460,65 |
| blank |
% |
52,8 |
17,8 |
9,1 |
11,1 |
9,1 |
| Manitoba |
000 $ |
1 657,98 |
1 904,39 |
628,18 |
820,82 |
907,57 |
| blank |
% |
28,0 |
32,2 |
10,6 |
13,9 |
15,3 |
| Saskatchewan |
000 $ |
326,99 |
1 091,95 |
832,42 |
77,03 |
247,32 |
| blank |
% |
12,7 |
42,4 |
32,3 |
3,0 |
9,6 |
| Alberta |
000 $ |
65 191,69 |
7 530,44 |
5 578,50 |
3 967,28 |
7 634,45 |
| blank |
% |
72,5 |
8,4 |
6,2 |
4,4 |
8,5 |
| Colombie-Britannique |
000 $ |
15 613,81 |
10 253,61 |
2 206,64 |
3 248,59 |
6 021,63 |
| blank |
% |
41,8 |
27,5 |
5,9 |
8,7 |
16,1 |
| Territoires |
000 $ |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
| blank |
% |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
| Canada |
000 $ |
390 019,48 |
170 247,75 |
61 671,78 |
72 966,25 |
95 199,81 |
| blank |
% |
49,4 |
21,5 |
7,8 |
9,2 |
12,0 |
Remarques :
- Le pourcentage figurant sous chaque catégorie de R-D correspond au pourcentage de toutes les dépenses engagées dans cette catégorie dans la province.
- Les dépenses présentées sous forme de pourcentage du total correspondent au pourcentage des dépenses de R-D dans cette province par rapport à l’ensemble des dépenses de R-D faites au Canada.
- Le total des colonnes et des rangs ne correspond pas nécessairement, car certains chiffres ont été arrondis.
- Dépenses courantes plus dépenses en immobilisations (équipement + amortissement) = total des dépenses de R-D.
Source : CEPMB